1、选择题 化学反应的发生不仅与物质的性质有关,还与反应物质的浓度、反应温度、相对量的多少等因素有关.下列各组的两物质中,不论在何种反应条件下,只要是能发生反应,就只能发生一个化学反应的是( )
A.Cu与HNO3溶液
B.CO2与NaOH溶液
C.Zn与H2SO4溶液
D.Fe2O3与HCl溶液
参考答案:D
本题解析:
本题难度:简单
2、填空题 工业上以黄铜矿(主要成分是CuFeS2,杂质不溶于水和酸)为原料,制备蓝色晶体G,其化学式为[Cu(NH3)4]SO4·H2O,涉及流程如下:
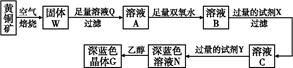
已知25 ℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表:
?
| Fe(OH)2
| Cu(OH)2
| Fe(OH)3
|
Ksp
| 8.0×10-16
| 2.2×10-20
| 4.0×10-38
|
完全沉淀pH
| ≥9.6
| ≥6.4
| ≥3.2
|
?
(1)加快黄铜矿焙烧速率,可采用的措施有
?(写两种)。
(2)加入双氧水可能发生反应的离子方程式为
?;
试剂X的化学式为
。
(3)常温下,0.1 mol/L试剂Y的pH=11,则该温度下,试剂Y的电离常数为
,用pH试纸测该溶液pH的方法是
? 。
(4)已知Cu(OH)2+4NH3·H2O

[Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式:
。
(5)在溶液N中加入乙醇的目的是
? 。
参考答案:(1)将黄铜矿粉碎、升高温度、增大空气流速(任选两种)
(2)2Fe2++2H++H2O2 2Fe3++2H2O CuO、Cu(OH)2、CuCO3或Cu2(OH)2CO3中的任一种
2Fe3++2H2O CuO、Cu(OH)2、CuCO3或Cu2(OH)2CO3中的任一种
(3)1×10-5 取一小片pH试纸放在玻璃片或表面皿上,用玻璃棒或胶头滴管取待测液点在pH试纸中部,待颜色变化稳定后与标准比色卡对比,读出pH
(4)K=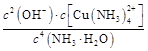
(5)降低G的溶解度,促进深蓝色晶体析出
本题解析:(1)对于固体反应物燃烧来讲,加快化学反应速率的措施有:①增大固体接触面积;②升高温度;③增大空气流速(即增大O2浓度);④利用超声波等;结合本题的情况,①②③都符合。
(2)从该题的工艺流程,再结合产物的阴离子,溶液Q应为H2SO4溶液,则溶液A中有:Fe2+、Fe3+、Cu2+和过量H2SO4,再结合所给数据,知此工艺应将Fe2+ Fe3+,然后让Fe3+水解成Fe(OH)3沉淀滤去,而Cu2+则不能形成沉淀,而要保证Fe3+水解形成沉淀[由于Fe3++3H2O
Fe3+,然后让Fe3+水解成Fe(OH)3沉淀滤去,而Cu2+则不能形成沉淀,而要保证Fe3+水解形成沉淀[由于Fe3++3H2O Fe(OH)3+3H+],则需要减小溶液酸性,所以双氧水的作用是将Fe2+氧化成为Fe3+,过量的试剂X的作用是能够促进Fe3+
Fe(OH)3+3H+],则需要减小溶液酸性,所以双氧水的作用是将Fe2+氧化成为Fe3+,过量的试剂X的作用是能够促进Fe3+ Fe(OH)3,即要促进Fe3+水解向右进行,那么则需要消耗H+又不能引入新的杂质,结合题中物质应该加入含铜元素又能消耗H+且不引入杂质的物质,则X为CuO、Cu(OH)2、CuCO3或Cu2(OH)2CO3。
Fe(OH)3,即要促进Fe3+水解向右进行,那么则需要消耗H+又不能引入新的杂质,结合题中物质应该加入含铜元素又能消耗H+且不引入杂质的物质,则X为CuO、Cu(OH)2、CuCO3或Cu2(OH)2CO3。
(3)由上面知溶液C主要为CuSO4溶液,则加入Y后能生成[Cu(NH3)4]SO4,则Y为氨水,NH3·H2O N
N +OH-,K=
+OH-,K=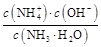 =
= =
=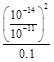 =
=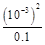 =
=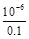 =10-5。
=10-5。
(4)书写时,氢氧化铜固体和水不计入表达式。
(5)深蓝色晶体的主要成分是[Cu(NH3)4]SO4·H2O,加入乙醇的目的是降低其溶解度,促进晶体析出。
本题难度:一般
3、选择题 为了检验溶液中是否含有Fe3+,可向溶液中加入(?)。
A.NaCl溶液
| B.铁片
| C.KSCN溶液
| D.石蕊溶液
参考答案:C
本题解析:滴加KSCN溶液,溶液变为血红色,证明含Fe3+,这是检验Fe3+的特征反应
本题难度:一般
4、实验题 (12分) 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。?
应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。
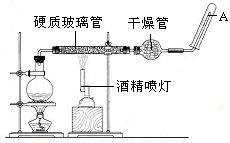
请回答该实验中的问题。
(1)写出该反应的反应方程式:?并指明该氧化还原反应的还原剂是?,氧化剂是?
(2)实验前必须对整套装置进行气密性检查,操作方法是?
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是??烧瓶底部放置了几片碎瓷片,碎瓷片的作是?
(4)酒精灯和酒精喷灯点燃的顺序是??
(5)干燥管中盛装是的物质是?,作用是?
参考答案:(每空1分,化学方程式2分)(1)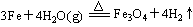 ;Fe;H2O ;Fe;H2O
(2)在玻璃管口A处接一断乳胶管,乳胶管头上连一段玻璃管,并将管口没入水中,用酒精灯火焰微热烧瓶底部,如果能够观察到没入水中的玻璃管口有气体逸出,停止加热后,玻璃管内有水柱上升,且较长时间水柱不回落,则标明该套装置气密性良好。
(3)为硬质玻璃管内Fe与水蒸气的反应 实验提供持续不断的水蒸气;防止爆沸事故的发生。
(4)先点燃酒精灯,产生水蒸气后,再点燃酒精喷灯;防止先点燃酒精喷灯所导致的Fe与O2的反应。
(5)碱石灰干燥剂;除去反应产生的H2中的水蒸气。
本题解析:
分析:对于铁与水蒸气反应的化学方程式,本题应该给出生成的铁的氧化物是哪一种,不然学生很难写出此化学方程式,还原剂的判定方法是与氧结合的物质,氧化剂是失去氧的物质.检验装置气密性的方法一般用加微热的方法,根据冒出的气泡和回流的水柱来判断.如果在一套装置中需要两处加热,一定要注意点燃加热仪器的顺序,一般是根据实验的安全性和对实验结果的影响来考虑.干燥管内固体干燥剂一般用无水氯化钙或固体氢氧化钠和碱石灰等,要注意干燥剂不能和被干燥的物质反应.点燃氢气前一定要检验纯度,防止发生爆炸.
解答:解:(1)铁与水蒸气发生氧化还原反应,考虑生成物应该是氢气和铁的氧化物,还原剂的判定方法是与氧结合的物质,这里就是铁,氧化剂是失去氧的物质,这里是水.故答案为:3Fe+4H O O Fe Fe O O +4H +4H ?铁 水 ?铁 水
(2)检查装置的气密性一般根据热胀冷缩的原理用加微热的方法:答案为:在玻璃管口A处接一段乳胶管,乳胶管头上连一段玻璃管,并将管口没入水中,用酒精灯火焰微热烧瓶底部,如果能够观察到没入水中的玻璃管口有气体逸出,停止加热后,玻璃管内有水柱上升,且较长时间水柱不回落,则标明该套装置气密性良好.
(3)因为反应物为水蒸气与铁,所以这里加热的目的就是提供水蒸气,放碎瓷片的目的是防止沸腾事故发生.答案为:为硬质玻璃管内Fe与水蒸气的反应实验提供持续不断的水蒸气
(4)点燃加热仪器的顺序要考虑实验的安全性和对实验结果的影响,在本实验中为了防止铁与空气中的氧气在加强热的条件下反应,应该先点燃酒精灯.故答案为:先点燃酒精灯,产生水蒸气后,再点燃酒精喷灯;防止铁与空气中的氧气在加强热的条件下反应,应该先点燃酒精灯.
(5)干燥氢气可以用碱石灰干燥剂.故答案:碱石灰 除去反应产生的H2中的水蒸气
故答案为:氢气;
点评:本题难度较大,涉及到很多高中化学知识,同学们要掌握常见的检验气密性,检验气体纯度的方法.
本题难度:一般
5、选择题 下列中学化学中常见物质的转化关系图中,反应条件及部分反应物和产物未全部注明,已知A.D为金属单质,其他均为化合物.试回答下列问题:
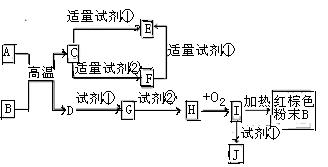
(1)写出物质C的化学式:?
(2)写出物质B的一种用途:?
(3)以J的饱和溶液制备胶体的操作为?
? ?。 ?。
(4)写出下列反应的方程式:
A→F的离子方程式?.
H→I的化学方程式??
试剂②可以由一种淡黄色固体粉末和一种常见液体发生反应而制得,其相应的化学方程式?
(5)某同学认为J中可能同时含有同一种金属元素的两种阳离子,若要确认其中低价金属阳离子的存在,应选用?(选填序号)
A、KSCN溶液和氯水? B、铁粉和KSCN溶液? C、浓氨水? D、酸性高锰酸钾?
参考答案:(1) Al2O3 (2分)
(2)常用作红色油漆和涂料(写出其中一种即得分)(2分)?
(3)取一个烧杯,加入20mL蒸馏水,加热至沸,然后向沸水中滴加I的饱和溶液(或者氯化铁饱和溶液)1mL~2mL,继续煮沸,待溶液(或者液体)呈红褐色为止;(3分,关键词,每处1分)
(4) 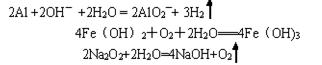
(5)D
本题解析:略
本题难度:一般
|
微信搜索关注"91考试网"公众号,领30元,获取公务员事业编教师考试资料40G

 [Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式: 。
[Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式: 。 2Fe3++2H2O CuO、Cu(OH)2、CuCO3或Cu2(OH)2CO3中的任一种
2Fe3++2H2O CuO、Cu(OH)2、CuCO3或Cu2(OH)2CO3中的任一种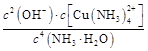
 Fe3+,然后让Fe3+水解成Fe(OH)3沉淀滤去,而Cu2+则不能形成沉淀,而要保证Fe3+水解形成沉淀[由于Fe3++3H2O
Fe3+,然后让Fe3+水解成Fe(OH)3沉淀滤去,而Cu2+则不能形成沉淀,而要保证Fe3+水解形成沉淀[由于Fe3++3H2O Fe(OH)3+3H+],则需要减小溶液酸性,所以双氧水的作用是将Fe2+氧化成为Fe3+,过量的试剂X的作用是能够促进Fe3+
Fe(OH)3+3H+],则需要减小溶液酸性,所以双氧水的作用是将Fe2+氧化成为Fe3+,过量的试剂X的作用是能够促进Fe3+ Fe(OH)3,即要促进Fe3+水解向右进行,那么则需要消耗H+又不能引入新的杂质,结合题中物质应该加入含铜元素又能消耗H+且不引入杂质的物质,则X为CuO、Cu(OH)2、CuCO3或Cu2(OH)2CO3。
Fe(OH)3,即要促进Fe3+水解向右进行,那么则需要消耗H+又不能引入新的杂质,结合题中物质应该加入含铜元素又能消耗H+且不引入杂质的物质,则X为CuO、Cu(OH)2、CuCO3或Cu2(OH)2CO3。 N
N +OH-,K=
+OH-,K=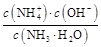 =
= =
=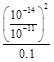 =
=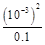 =
=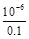 =10-5。
=10-5。