时间:2018-03-17 06:45:34
1、选择题 下表是五种银盐的溶度积常数(25 ℃),下列有关说法错误的是
| 化学式 | AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 溶度积 | 1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 5.0×10-13 | 8.3×10-17 |
参考答案:D
本题解析:A.由表中数据可知溶解度最大的是Ag2SO4,微溶于水,其它物质难溶,A正确;B.Ag2S溶度积远小于AgCl,Ag2S难溶于水,在AgCl的饱和溶液中加入Na2S,则可以生成黑色的Ag2S沉淀,B正确;C.化学平衡为动态平衡,当外界条件发生改变时,平衡发生移动,C正确;D.AgCl、AgBr、AgI的溶解度依次减小,向AgI的悬浊液中加入0.1mol/L NaCl溶液,Q< Ksp(AgCl),无法实现沉淀的转化,D错误,选D。
考点:考查难溶电解质的溶解平衡问题。
本题难度:一般
2、填空题 (16分)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)请完成FeO42-与水反应的方程式:4FeO42-+10H2O 4Fe(OH)3+8OH-+_____。
4Fe(OH)3+8OH-+_____。
K2FeO4在处理水的过程中所起的作用是?和?。
(2)常温下,Fe(OH)3 的Ksp = 4.0×10-38,请写出Fe(OH)3在水中的溶解平衡方程式?
(3)将适量K2FeO4配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。第(1)题中的反应为FeO42-变化的主反应,则温度对该反应的反应速率和平衡移动的影响是??;发生反应的△H ??0(填“>”、“<”或“=”)。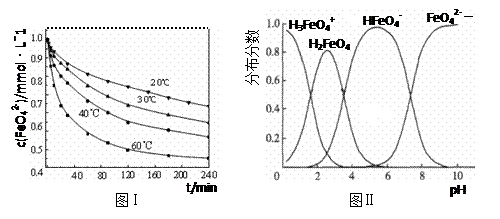
(4)FeO42-在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是?(填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=2的这种溶液中加KOH溶液至pH=10,HFeO4-的分布分数先增大后减小
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:
H2FeO4+OH-=HFeO4-+H2O
参考答案:(16分)
(1)3O2?(2分)杀菌消毒,吸附(净水)(或其他合理答案)(各2分,共4分)
(2) Fe(OH)3(S) ?Fe3+(aq)+ 3 OH-(aq)?(2分)
?Fe3+(aq)+ 3 OH-(aq)?(2分)
(3)温度升高,反应速率加快,平衡向正反应方向移动(或其他合理答案)(4分)
>(2分)
(4)B(2分)
本题解析:略
本题难度:一般
3、选择题 在一定温度下,当Mg(OH)2固体在水溶液中达到下列平衡时:Mg(OH)2 Mg2++2OH-,要使Mg(OH)2固体减少而c(Mg2+)不变,可采取的措施是 ( )
Mg2++2OH-,要使Mg(OH)2固体减少而c(Mg2+)不变,可采取的措施是 ( )
A.加MgSO4
B.加HCl溶液
C.加NaOH
D.加少量水
参考答案:D
本题解析:MgSO4易溶于水,加MgSO4会增加c(Mg2+),A错误;加HCl溶液会中和OH-平衡右移,使c(Mg2+)增大,B错误;加NaOH使c(OH-)增大平衡左移,c(Mg2+)减小,C错误;加少量水时c(Mg2+)减少,平衡右移重新达到平衡时,c(Mg2+)又与原平衡相同,D正确。
本题难度:一般
4、简答题 (1)向2.0mL浓度为0.1mol/L的KCl、KI混合溶液中滴加1~2滴0.01mol/LAgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp______(填“小”或“大”).
(2)医药级二水合氯化钙(CaCl2?2H2O)样品中Cl-含量的测定方法是:a.称取0.7500g样品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用0.05000mol/LAgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值是20.39mL.
①上述测定过程中需用溶液润洗的仪器是______,如果在测定前没有润洗该仪器,测定结果(质量分数)会
______(选填“偏大”、“偏小”或“无影响”).
②计算上述样品中CaCl2?2H2O的质量分数.
参考答案:(1)在溶液中溶度积小的沉淀先析出,已知向2.0mL浓度为0.1mol/L的KCl、KI混合溶液中滴加1~2滴0.01mol/LAgNO3溶液,振荡,沉淀呈黄色,说明先生成AgI,所以AgI的溶解度小,即AgCl的Ksp比AgI的Ksp大;故答案为:大;
(2)①标准溶液为硝酸银溶液,所以用酸式滴定管盛放,在使用前应先用硝酸银溶液进行润洗;若没有润洗该仪器,则硝酸银浓度减小,滴定时消耗的硝酸银的体积偏大,根据c(未知)=c(已知)?c(已知)V(未知),可知测定结果会偏大;
故答案为:酸式滴定管;偏大;
②已知称取0.7500g样品,溶解,在250mL容量瓶中定容,量取25.00mL待测溶液于锥形瓶中,所以样品中n(Cl-)=0.05000mol?L-1×0.02039L×10=0.010195mol,根据n(AgCl)=2n(CaCl2?2H2O),则n(CaCl2?2H2O)=0.0050975mol,所以m(CaCl2?2H2O)=0.0050975mol×147g/mol=0.7493325g,
则有:0.74933250.7500×100%=99.9%,
答:样品中CaCl2?2H2O的质量分数为99.9%.
本题解析:
本题难度:一般
5、选择题 某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示.该温度下,下列说法正确的是( )
A.含有大量SO42-的溶液中肯定不存在Ag+
B.0.02mol/L的AgNO3溶液与0.2mol/L的Na2SO4溶液等体积混合不会生成沉淀
C.Ag2SO4的溶度积常数(Ksp)为1×10-3
D.a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点
参考答案:A.Ag2SO4在水中沉淀溶解平衡为:Ag2SO4(s)?2Ag+(aq)+SO42-(aq),溶解为可逆过程,溶液中一定存在Ag+,故A错误;
B.0.02mol/L的AgNO3溶液与0.2mol/L的Na2SO4溶液等体积混合,c(SO42-)=0.1mol/L时,c(Ag+)=0.01mol/L,c2(Ag+)×c(SO42-)=1×10-5<ksp,不会生成沉淀,故B正确;
C.由图象可知,当c(SO42-)=5×10-2mol/L时,c(Ag+)=2×10-2mol/L,则ksp=c2(Ag+)×c(SO42-)=2×10-5,故C错误;
D.加热蒸发时,溶液中银离子和硫酸根离子浓度都增大,故D错误.
故选B.
本题解析:
本题难度:一般