时间:2018-03-17 06:44:13
1、选择题 现有常温下的四份溶液:① 0.01mol/LCH3COOH;② 0.01mol/LHCl;③ pH=12的氨水;④ pH=12的NaOH溶液。下列说法正确的是
A.①中水的电离程度最小,②③④中水的电离程度一样大
B.将②③混合,若pH=7,则消耗溶液的体积:②<③
C.将①、④混合,若有c(CH3COO¯)>c(H+),则混合液一定呈碱性
D.将①、④等体积混合,所得溶液中一定有:c(OH¯)=c(H+) + c(CH3COOH)
参考答案:D
本题解析:A、酸碱抑制水的电离,CH+或COH-越大,水的电离程度越小。水的电离程度:③最小,②④相近,①最大。错误;B、将②③混合,若pH=7,则消耗溶液的体积:②>③。因为氨水是弱电解质,浓度大,则消耗溶液的体积小。错误;C、未给定体积,若CH3COOH过量,则混合液呈酸性;若恰好反应或碱过量,则混合液一定呈碱性。错误;D、将①、④等体积混合,得CH3COONa,由质子守恒得c(OH¯)=c(H+) + c(CH3COOH),正确。
考点:考查溶液里的离子浓度比较等相关知识。
本题难度:困难
2、填空题 (14分)某温度下,水的离子积Kw=l×10-13。有酸溶液A,pH=a;碱溶液B,pH=b。为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置。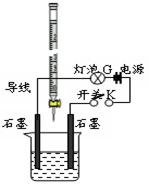
(1)实验时,烧杯中应盛 (选A或B)溶液。
(2)若A为一元强酸,B为一元强碱,且a+b=13。该同学在烧杯中先加入其中一种溶液,闭合开关K,测得烧杯中灯泡的亮度为10(假设亮度由暗到亮表示为1、2、3、…10、11、12、… 20)。断开开关K,将滴定管中的溶液逐滴加入到烧杯中。当从滴定管滴入烧杯中的溶液体积和烧杯中盛有的溶液体积相等时,停止滴加溶液并闭合开关K,此时灯泡G的亮度约为 ,原因是 。烧杯中得到的溶液pH= 。
(3)若A为强酸,B为强碱,且a+b=13。断开开关K,将滴定管中的溶液逐滴加入到烧杯中。当测得烧杯中溶液pH和“⑵”中最后得到的溶液pH相同时,停止滴加溶液。此时烧杯中的溶液中阳离子浓度大于阴离子浓度,原因可能是 。
(4)若A的化学式为HR,B的化学式为MOH,且a+b=13,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为_ _。
此时烧杯中的混合溶液中,微粒浓度大小关系一定正确的是_ _____(填序号)。
①c(MOH)>c(M+)>C(R-)>c(H+)>c(OH-)
②c(HR)>c(M+)>c(R-)>c(OH-)>c(H+)
③c(R-)>c(M+)>c(H+)>c(OH-)
④c(M+)>c(R-)>c(OH-)>c(H+)
⑤c(M+)+ c(H+)=c(R-)+c(OH-)
⑥c(MOH)=c(H+)-c(OH-)
参考答案:⑴ B
⑵ 5 反应后烧杯中自由离子的浓度约为原溶液的一半 6.5
⑶ A为多元强酸(答案合理就可给分)
⑷ M++H2O 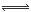 MOH+H+ ④⑤
MOH+H+ ④⑤
本题解析:⑴图中为酸式滴定管,所以烧杯中应盛碱溶液B;⑵当从滴定管滴入烧杯中的溶液体积和烧杯中盛有的溶液体积相等时,恰好完全反应,生成一元强酸强碱盐,离子数目与原B溶液中相等,体积约为原来2倍,离子的浓度约为原溶液的一半,导电能力约为原来1/2,溶液为中性pH=6.5。(3)溶液为中性时,溶液中阳离子浓度大于阴离子浓度,可能A为多元强酸;⑷a+b=13说明酸中c(H+)与碱中c(OH-)相等,二者混合后溶液呈碱性,说明碱为弱碱,所以碱过量,弱碱阳离子M+水解,水解反应的离子方程式为M++H2O 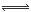 MOH+H+;由于溶液呈碱性,c(OH-)>c(H+),①、③错误,根据c(OH-)>c(H+)和电荷守恒c(M+)+c(H+)=c(R-)+c(OH-)可得c(M+)>c(R-),因为OH-和H+均来自于弱电解质的电离,其浓度应该很小,故c(M+)>c(R-)>c(OH-)>c(H+),所以④正确,根据电荷守恒是关系,⑤正确,若HR是强酸,此时溶液中不再有HR分子,②是错误的,由于(3)的混合溶液中MOH有大量剩余,即c(MOH)>0,若⑥正确,则c(H+)>c(OH-),溶液显酸性,所以⑥错误。
MOH+H+;由于溶液呈碱性,c(OH-)>c(H+),①、③错误,根据c(OH-)>c(H+)和电荷守恒c(M+)+c(H+)=c(R-)+c(OH-)可得c(M+)>c(R-),因为OH-和H+均来自于弱电解质的电离,其浓度应该很小,故c(M+)>c(R-)>c(OH-)>c(H+),所以④正确,根据电荷守恒是关系,⑤正确,若HR是强酸,此时溶液中不再有HR分子,②是错误的,由于(3)的混合溶液中MOH有大量剩余,即c(MOH)>0,若⑥正确,则c(H+)>c(OH-),溶液显酸性,所以⑥错误。
考点:弱电解质在水溶液中的电离平衡、pH的简单计算、离子浓度大小比较。
本题难度:困难
3、选择题 把0.2mol/L NH4Cl溶液与0.1mol/L NaOH溶液等体积混合后溶液中下列微粒的物质的量浓度的关系正确的是
A.[NH4+]=[Na+]=[OH-]>[NH3·H2O]
B.[NH4+]=[Na+]>[NH3·H2O]>[OH-]
C.[NH4+]>[Na+]>[OH-]>[NH3·H2O]
D.[NH4+]>[Na+]>[NH3·H2O]>[OH-]
参考答案:D
本题解析:此类型题目,若发生化学反应,优先考虑化学反应,通过化学反应各种离子浓度能比较出来,则不必考虑水解和电离,因为弱电解质电离或盐的水解程度都很小,对离子浓度,影响不大,若通过化学反应各种离子浓度大小比较不出来则再考虑水解和弱电解质电离。此题中NH4Cl和NaOH发生反应:NH4Cl+NaOH=NaCl+NH3·H2O生成NH3·H2O,同时NH4+有剩余若不考虑NH3·H2O电离和NH4+水解,有[NH3·H2O]=[NH4+]=[Na+]=0.5mol/L,此时考虑电离和水解: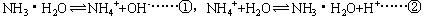
①发生使溶液 [NH4+]增大,②反应使溶液[NH4+]减小,溶液[NH4+]是增大还是减小,取决于两个反应哪一个为主要,根据经验规则可知,盐的水解和弱电解质的电离,以电离为主,因此[NH4+]增大,大于[Na+],同样分别[NH3·H2O]应减少,小于[Na+],溶液中[OH-]来自NH3·H2O电离,电离很微弱,[OH-]浓度很小,故微粒浓度顺序为[NH4+]>[Na+]>[NH3·H2O]>[OH-],选择D。
本题难度:一般
4、选择题 NH4Cl稀溶液中分别加入少量下列物质或改变如下条件,能使比值c(NH4+)/c(Cl—)一定增大的是
①HCl气体 ②氨气 ③H2O ④NH4Cl固体 ⑤NaOH固体 ⑥降温
A.③④⑤
B.②④
C.②③⑥
D.②④⑥
参考答案:D
本题解析:氯化铵中存在水解平衡,NH4Cl+H2O NH3·H2O+HCl。通入氯化氢,则抑制水解,但比值是减小的;通入氨气,抑制水解,比值增大;稀释促进水解,比值减小;加入氯化铵固体,抑制水解,比值增大;氢氧化钠固体促进水解,比值减小;水解吸热,降低温度,抑制水解,比值增大,因此正确的答案选D。
NH3·H2O+HCl。通入氯化氢,则抑制水解,但比值是减小的;通入氨气,抑制水解,比值增大;稀释促进水解,比值减小;加入氯化铵固体,抑制水解,比值增大;氢氧化钠固体促进水解,比值减小;水解吸热,降低温度,抑制水解,比值增大,因此正确的答案选D。
本题难度:一般
5、选择题 下列物质的溶液在蒸发皿中加热蒸干并灼烧,最后得到该物质固体的是
A.氯化铝
B.硫酸镁
C.亚硫酸钠
D.碳酸氢钠
参考答案:B
本题解析:A、氯化铝在加热过程中促进水解,由于水解生成氯化氢有挥发性,所以会完全水解成氢氧化铝,氢氧化铝灼烧得到氧化铝,不选A;B、硫酸镁在加热时促进水解,但由于硫酸不能挥发,最后又和氢氧化镁反应生成硫酸镁,选B;C、亚硫酸钠在加热过程中容易和氧气反应生成硫酸钠而变质,不选C;D、碳酸氢钠受热会分解成碳酸钠,不选D。
考点:盐类水解的应用。
本题难度:一般