时间:2018-03-17 06:38:59
1、选择题 下列热化学方程式中的反应热为可燃物的燃烧热的是[ ]
A.H2(g)+1/2O2(g)=H2O(g) △H =-241.8kJ·mol—1
B.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H =-846.3kJ·mol—1
C.C(s)+O2(g)=CO2(g) △H =-393.5kJ·mol—1
D.C3H8(g)+5O2(g)=3CO(g)+4H2O(l)△ H = -2044.0kJ·mol—1
2、选择题 25℃时,下列溶液中水的电离程度最小的是
A.0.01 mol/L盐酸
B.0.01 mol/L Na2CO3溶液
C.pH =" 4" NaHSO3溶液
D.pH =11氨水
3、填空题 某地的酸雨中,含c (Na+) = 7.0×10-6mol/L,c (Cl-) = 4.5×10-5 mol/L,c (NH4+) = 2.3×10-5 mol/L,c (SO42-) = 2.5×10-6 mol/L,则该地酸雨的pH约为?。.
4、选择题 在K2SO4、Al2(SO4)3和明矾[KAl(SO4)2·12H2O]的混合液中,SO42-浓度为0.2mol/L,当加入等体积0.4mol/L的KOH溶液时,生成的沉淀恰好完全溶解。则反应后溶液中K+的浓度约为(?)
A.0.45mo1/L
B.0.25mol/L
C.0.225mol/L
D.0.9mol/L
5、选择题 25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是
[? ]
A.2H+(aq) +SO42-(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(1);△H=57.3 kJ/mol
B.KOH(aq)+1/2H2SO4(aq)=1/2K2SO4(aq)+H2O(l); △H=57.3kJ/mol
C.C8H18(I)+ 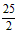 O2(g)=8CO2(g)+ 9H2O; △H=5518 kJ/mol
O2(g)=8CO2(g)+ 9H2O; △H=5518 kJ/mol
D.2C8H18(g)+25O2(g)=16CO2(g)+18H2O(1); △H=5518 kJ/mol