时间:2018-03-17 06:38:37
1、选择题 按下图的装置进行电解,A极是铜锌含金,B极为纯铜。电解质溶液中含有足量的Cu2+。 通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增加0.03g,则A极合金中Cu、Zn的原子个数比为 
A.4:1
B.3:1
C.2:1
D.5:3
参考答案:B
本题解析:B是阴极,始终是铜离子放电析出铜。A是阳极,先是锌失去电子进入溶液,然后是铜失去电子,进入溶液。所以根据反应式Zn+Cu2++=Zn2++Cu可知每消耗1mol锌,溶液质量增加1g,所以合金中锌的物质的量是0.03mol,同时析出的铜也是0.03mol,质量是1.92g。所以合金中铜的质量是7.68g-1.92g=5.76g,物质的量是0.09mol,所以合金中Cu、Zn的原子个数比为3:1。答案选B。
本题难度:一般
2、选择题 如图所示的装置中,a、b都是惰性电极,通电一段时间后,b电极附近溶液呈红色。下列说法中正确的是( )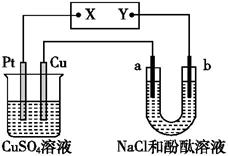
A.X是负极,Y是正极
B.Pt是阴极,Cu是阳极
C.CuSO4溶液的酸性逐渐增强
D.CuSO4溶液的酸性不变
参考答案:C
本题解析:通电一段时间后,b电极附近溶液呈红色,这说明b电极周围溶液显碱性,从b电极是阴极,则Y是负极,X是正极,Pt是阳极,溶液中的OH-放电生成氧气。铜电极是阴极,铜离子放电析出铜,同时还有硫酸生成,所以选项A、B、D都是错误的,正确的答案选C。
本题难度:一般
3、填空题 从H+、K+、Cu2+、Cl-、SO 中选取适当的离子组成符合下列情况的电解质,进行电解(阳离子只能使用一次)。
中选取适当的离子组成符合下列情况的电解质,进行电解(阳离子只能使用一次)。
(1)以碳棒为电极进行电解,电解质的物质的量减少,水的物质的量保持不变,两极都有气体生成,气体体积相同,则该电解质的化学式为____________,电解的阴极反应____________,电解的阳极反应________________________,电解的总方程式是______________________。
(2)以铂丝为电极进行电解,水的物质的量减少,电解质的物质的量保持不变,两极都有气体生成,气体体积比为2:1,则该电解质的化学式为____________________,阴极反应式为____________________,阳极反应式为___________________________。
(3)惰性电解,电解质的物质的量减少,水的物质的量也减少,pH下降,则电解质的化学式为____________,电解的总方程式为__________________________________。
参考答案:10分(每空1分,最后一空2分)
(1)HCl ;2H++2e-=H2↑?;2Cl--2e-=Cl2↑ ; 2HCl H2↑+Cl2↑
H2↑+Cl2↑
(2)K2SO4 ;4H++4e-=2H2↑?;4OH--4e-=2H2O+O2↑
(3)CuSO4 2CuSO4+2H2O 2Cu+O2↑+2H2SO4
2Cu+O2↑+2H2SO4
本题解析:阳离子放电顺序为Cu2+>Na+>H+,阴离子放电顺序为Cl->OH->SO42-。
(1) 电解质的物质的量减少,水的物质的量保持不变,两极都有气体生成,气体体积相同,说明电解的HCl,铜离子、氯离子放电,则电解质质量减小,水量不变,故电解质的化学式为HCl,电解的阴极反应为2H++2e-=H2↑,电解的阳极反应为2Cl--2e-=Cl2↑,电解的总方程式是2HCl H2↑+Cl2↑。
H2↑+Cl2↑。
(2) 以铂丝为电极进行电解,水的物质的量减少,电解质的物质的量保持不变,两极都有气体生成,气体体积比为2:1,说明电解的是)K2SO4,氢离子、氢氧根离子放电,则电解质质量不变,水量减少,故该电解质的化学式为K2SO4,阴极反应式为4H++4e-=2H2↑,阴极反应式为4OH--4e-=2H2O+O2↑。
(3)惰性电解,电解质的物质的量减少,水的物质的量也减少,pH下降,说明电解的是CuSO4,则铜离子、氢氧根离子(或氯离子、氢离子)放电,所以电解质和水量都减少,故电解质的化学式为CuSO4,电解的总方程式为2CuSO4+2H2O 2Cu+O2↑+2H2SO4。
2Cu+O2↑+2H2SO4。
点评:本题考查电解原理,明确离子的放电顺序是解答本题的关键,注意电极材料与发生的电极反应即可解答,题目难度大。
本题难度:一般
4、填空题 (10分)某同学用碳棒、纯铜片、直流电源和稀硫酸为原材料,实现了在通常条件下不能发生的反应:Cu + H2SO4(稀) = CuSO4 + H2↑
(1)请在右边方框中画出能够实现这一反应的装置图。
(2)在设计实验实际操作时,由于装置连接不当,他看到了完全不同的实验现象:碳棒和铜片上均有无色气泡产生,溶液并未变为蓝色。请你分析其原因?①?。
假设按照该方案进行实验,且收集到碳棒上产生气体体积为11. 2L(标准状况下)。则该过程中铜片上发生的反应式为?②?。此时要使溶液恢复到实验前的状态,需加入?③?(写出该物质的化学式),其质量为? ④?。
参考答案:(1) 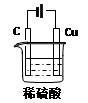 ?
?
(2)①两极与电源的正负极接反了?②2H++2e-= H2↑?③H2O?④18g
本题解析:(1)根据方程式可知,Cu做阳极,石墨做阴极,H2SO4做电解质溶液,所以装置图为
(2)如果电极放反,则阳极为:4OH- -4e-=O2↑+2H2O,阴极为2H++2e-=H2↑,所以看不到预期的现象。要想恢复到实验前的状态需要加入水,因为生成O2 11.2L,则需要水18g。
点评:电解中最关键的是准确判断出电极上离子的放电顺序。在判断电解产物时,首先判断阳极电极材料。如果是活性电极,则电极本身失去电子。如果是惰性电极,则溶液中的阴离子失去电子。而阴极是溶液中的阳离子得到电子,所以需要熟练记住常见离子的放电顺序。
本题难度:一般
5、选择题 用图中装置(X、Y是直流电源的两极)分别进行下列各组实验,则下表中所列各项对应关系均正确的一组是
[? ]