时间:2018-03-17 06:38:37
1、选择题 用石墨电极电解100 mL H2SO4与CuSO4的混合溶液,通电一段时间后,两极均收集到2.24 L气体(标准状况),则原混合溶液中Cu2+的物质的量浓度为(? )
A.1 mol·L-1
B.2 mol·L-1
C.3 mol·L-1
D.4 mol·L-1
参考答案:A
本题解析:用石墨电极电解100 mL H2SO4与CuSO4的混合溶液,阳极是氢氧根离子放电生成氧气,阴极先是铜离子放电生成铜,然后是氢离子放电生成氢气,而生成2.24L的氢气时对应阳极生成的氧气的体积是1.12L,所以与铜离子放电对应的氢氧根离子放电生成的氧气的体积是2.24L-1.12L=1.12L,物质的量是0.05mol,转移电子的物质的量是0.05mol×4=0.2mol,根据得失电子守恒规律,放电的铜离子的物质的量是0.1mol,所以原混合溶液中Cu2+的物质的量浓度为0.1mol/0.1L=1mol/L,答案选A。
本题难度:一般
2、选择题 若按下图甲装置进行实验,图乙中x、y分别表示流入电极的电子、某产物的物质的量。若将甲装置中的溶液改为等体积、等物质的量浓度的CuSO4和NaCl溶液的混合液,电解过程中溶液的pH随时间t变化的示意图如丙所示。则下列叙述中正确的是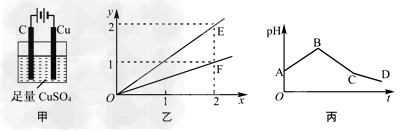
[? ]
A.E表示反应生成Cu的物质的量?
B.F表示反应生成H2SO4
C.BC段阳极产物是Cl2?
D.CD段电解的物质是NaCl
参考答案:B
本题解析:
本题难度:一般
3、填空题 碲(Te)为ⅥA族元素,是当今高新技术新材料的主要成分之一。工业上可从电解精炼铜的阳极泥中提取碲。
(1)粗铜中含有Cu和少量Zn、Ag、Au、TeO2及其他化合物,电解精炼后,阳极泥中主要含有TeO2、少量金属单质及其他化合物。电解精炼粗铜时,阳极电极反应式为 。
(2)TeO2是两性氧化物,微溶于水,可溶于强酸或强碱。从上述阳极泥中提取碲的一种工艺流程如下:
①“碱浸”时TeO2发生反应的化学方程式为 。
②“沉碲”时控制溶液的pH为4.5-5.0,生成TeO2沉淀。如果H2SO4过量,溶液酸度过大,将导致碲的沉淀不完全,原因是 ;防止局部酸度过大的操作方法是 。
③“酸溶”后,将SO2通入TeCl4溶液中进行“还原”得到碲,该反应的化学方程式是 。
参考答案:(1)Zn-2e-=Zn2+ Cu-2e-=Cu2+ (共4分,各2分)
(2)① TeO2+2NaOH=Na2TeO3+H2O (3分)
②TeO2是两性氧化物,H2SO4过量会导致TeO2继续与H2SO4反应导致损失。(3分)
缓慢加入H2SO4,并不断搅拌 (3分)
③ TeCl4 + 2SO2 + 4H2O="Te" + 4HCl + 2H2SO4 (3分)
本题解析:(1)电解精炼粗铜时,粗铜中的Cu和少量Zn在阳极发生氧化反应,Zn比Cu活泼,先失电子,所以阳极电极反应式为Zn-2e-=Zn2+ Cu-2e-=Cu2+
(2)①TeO2是两性氧化物,与氢氧化钠发生类似氧化铝与氢氧化钠的反应,化学方程式为TeO2+2NaOH=Na2TeO3+H2O;
②因为TeO2是两性氧化物,H2SO4过量会导致TeO2继续与H2SO4反应导致损失。防止局部酸度过大的操作方法是缓慢加入H2SO4,并不断搅拌;
③SO2还原TeCl4为Te,本身被氧化为硫酸,化学方程式为TeCl4+2SO2+4H2O=Te+4HCl+2H2SO4
考点:考查粗铜精炼的电解反应式的书写,对给定条件的化学方程式的判断及书写,实验操作的判断
本题难度:困难
4、简答题 (16分)复方过氧化氢消毒剂具有高效、环保、无刺激无残留,其主要成分H2O2。
(1)H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了甲、乙两种实验装置。
若利用甲实验,可通过观察________现象,从而定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是________;若利用乙实验可进行定量分析,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是________。
(2)在含有表面活性剂的酸性水溶液中,以碳为电极,通直流电进行电解可制取氢气和过氧化氢,过氧化氢在 (填“阴极”、“阳极”)产生。
以H2O2和硼氢化合物NaBH4(B的化合价为+3价)作原料的燃料电池,可用作通信卫星电源。其工作原理如图所示,写出a极上的电极反应式: ,正极材料采用MnO2,MnO2除了作电极材料之外还可能具有的作用为 
(3)锗(Ge)与碳是同主族元素,最新研究表明有机锗具有明显的抗肿瘤活性,锗不与NaOH 溶液反应,但在有H2O2存在时可与NaOH 溶液反应生成锗酸盐,其化学方程式为 。
参考答案:(1)产生气泡的快慢 (2分) 可以消除阴离子不同对实验的干扰 (2分) 产生40mL气体所需的时间(2分)
(2)阳极(2分) BH4- + 8OH- - 8e- = BO2- + 6H2O (3分) MnO2对电极反应可能具有催化作用(2分)
(3) Ge+2 H2O2+2NaOH=Na2GeO3+3H2O(3分)
本题解析:(1)比较Fe3+和Cu2+对H2O2分解的催化效果,即为比较过氧化氢分解的反应速率的大小,若利用甲实验,可通过观察产生气泡的快慢现象,从而定性比较得出结论。将FeCl3改为Fe2(SO4)3更为合理,其理由是可以消除阴离子不同对实验的干扰;若利用乙实验可进行定量分析,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是产生40mL气体所需的时间。(2)在含有表面活性剂的酸性水溶液中,以碳为电极,通直流电进行电解可制取氢气和过氧化氢,氢离子得电子发生还原反应,在阴极生成氢气,水失电子发生氧化反应,过氧化氢在阳极产生。以H2O2和硼氢化合物NaBH4(B的化合价为+3价)作原料的燃料电池,由题给装置图知,a极上的电极反应式:BH4- + 8OH- - 8e- = BO2- + 6H2O ,正极材料采用MnO2,MnO2除了作电极材料之外还可能具有的作用为MnO2对电极反应可能具有催化作用。(3)锗(Ge)与碳是同主族元素,根据题给信息知,锗在有H2O2存在时可与NaOH 溶液反应生成锗酸盐和水,其化学方程式为Ge+2 H2O2+2NaOH=Na2GeO3+3H2O。
考点:考查化学反应速率的实验测定、电解原理及电极反应式的书写、化学方程式的书写。
本题难度:一般
5、选择题 下列说法正确的是
A.电解氯化镁饱和溶液,可制得金属镁
B.煤可经分馏获得洁净的燃料
C.非金属材料中不可以含有金属元素
D.用丁达尔效应可以区分胶体和溶液
参考答案:D
本题解析:略
本题难度:一般