时间:2018-03-17 06:35:14
1、选择题 三种正盐的混合溶液中含有0.2molNa+,0.25molMg2+,0.4molCl-,则SO42-的物质的量为
A.0.1?mol
B.0.3?mol
C.0.5?mol
D.0.15?mol
参考答案:D
本题解析:分析:溶液呈电中性,根据电荷守恒有n(Na+)+2n(Mg2+)=n(Cl-)+2n(SO42-),据此计算.
解答:溶液呈电中性,根据电荷守恒有n(Na+)+2n(Mg2+)=n(Cl-)+2n(SO42-),故
0.2mol×1+0.25mol×2=1×0.4mol+2n(SO42-)
解得:n(SO42-)=0.15mol,
故选D.
点评:本题考查物质的量的有关计算,难度不大,注意电解质溶液中利用电荷守恒进行浓度、物质的量的计算.
本题难度:简单
2、简答题 空气吹出法工艺是目前“海水提溴”的最主要方法之一,其工艺流程如下: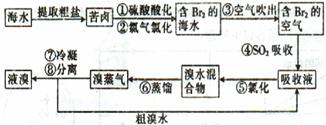
(1)目前,从海水中提取的溴约占世界溴年产量的?。
(2)步骤①中用硫酸酸化可提高Cl2的利用率,其原因是?。
(3)步骤④的离子方程式。?
(4)步骤⑥的蒸馏过程中,溴出口温度要控制在80?90℃。温度过高或过低都不利于生产,理由是?。
(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差较大的特点进行分离。分离仪器的名称是??,分离吋液溴从分离器的??(填“上口”或“下口”)排出。
(6)不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氯化”的原因是??。
(7)某同学测得苦卤中溴的含量为0.8g·L-1,已知步骤①?⑥中溴共损失了25%,步骤⑦和步骤⑧又共损失了所得溴蒸气的10%,若处理10 m3这样的苦卤,可得到液溴?mol。
参考答案:
(1)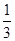
(2)酸化可抑制Cl2、Br2与水反应
(3)Br2+SO2+2H2O==4H++2Br-+SO42-
(4)温度过高,大量水蒸气随水排出去,溴蒸气中水分增加,温度过低,溴不能完全蒸出,吸收率低。
(5)分液漏斗;下口
(6)氯化后的海水虽然含有溴单质,但浓度低,如果直接蒸馏原料,产品成本高,“空气吹出、SO2吸收、氯化”的过程实际是一个溴的浓缩过程。
(7)33.75
本题解析:(1)从海水中提取的溴约占世界溴年产量的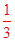 。
。
(2)Cl2、Br2与水反应生成酸,加入硫酸可抑制Cl2、Br2与水反应。
(3)步骤④是溴单质将SO2氧化。
(4)温度过高,会增加水蒸气,温度过低,则溴不能完全蒸出。
(5)分离溴水和液溴,应用分液漏斗。因液溴密度大于水,因此液溴从分液漏斗下口排出。
(6)氯化后的海水含溴量低。
(7)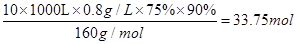 。
。
本题难度:一般
3、填空题 一种无色透明溶液中,可能含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、HSO3-、HCO3-、I-和Cl-,取该溶液进行如下实验:
①将溶液滴在pH试纸上,呈红色。
②将少许溶液浓缩后加入铜片和硫酸,有无色气体析出,此气体通空气则立即变成红棕色。
③取少许溶液滴入BaCl2试液,则产生白色沉淀。
④取实验③中的澄清溶液,滴入AgNO3试液,产生不溶于稀HNO3的白色沉淀。
⑤另取少许溶液,滴入NaOH溶液,有白色沉淀生成,当NaOH过量时,又有部分白色沉淀溶解。
根据以上现象判断,原溶液中肯定不存在的离子是?;肯定存在的离子是?;不能作出判断的离子是?。
参考答案:(6分)①HCO3-? Ba2+? Fe2+?、HSO3—、I — ②Al3+? SO42-? NO3-、Mg2+③Cl-、K+
— ②Al3+? SO42-? NO3-、Mg2+③Cl-、K+
本题解析:略
本题难度:一般
4、选择题 若NA代表阿伏加德罗常数的数值,下列叙述正确的是
A.标准状况下,5.6L?CCl4含有的C-Cl共价键数为NA
B.2.4g?Mg与足量稀硫酸反应时,失去电子数为0.1NA
C.1?L0.5mol/L?CuCl2?溶液中含有的?Cu2+数为0.5NA
D.16g氧气和臭氧的混合物中氧原子数为NA
参考答案:D
本题解析:分析:A.标准状况下CCl4是液体;
B.一个镁原子失去2个电子;
C.Cu2+能发生水解;
D.氧气和臭氧是同素异形体,组成一样,原子个数等于质量比摩尔质量乘以阿伏伽德罗常数.
解答:A.标准状况下CCl4是液体,5.6L?CCl4的物质的量不是0.25mol,故A错误;
B.2.4g?Mg的物质的量是0.1mol,失去电子数为0.2NA,故B错误;
C.氢氧化铜是弱电解质,Cu2+能发生水解,Cu2+数小于0.5NA,故C错误;
D.氧气和臭氧是同素异形体,成分一样,原子个数等于质量比摩尔质量乘以阿伏伽德罗常数,N= ×NA=
×NA= NA=NA,故D正确.
NA=NA,故D正确.
故选D.
点评:本题考查阿伏加德罗常数,题目难度不大,注意物质的组成、结构、性质以及物质存在的外界条件和聚集状态等问题.
本题难度:困难
5、实验题 (14分)高锰酸钾广泛用作氧化剂、防腐剂、消毒剂、除臭剂及解毒剂。常见的制备流程如下: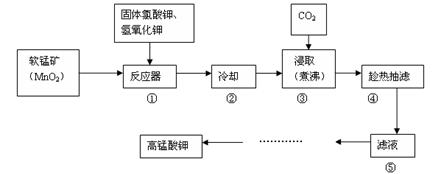
已知:a.3MnO2+KClO3+6KOH=3K2MnO4+KCl+3H2O B.3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
请回答下列问题:
(1)步骤①中反应所选用的坩埚不能用?。
A.石英坩埚? B.铁坩埚? C.瓷坩埚? D.石墨坩埚
(2)步骤③通CO2的目的是为了调节溶液的pH,能否改用氯化氢?(填“能”或“否”),原因是?。
(3)步骤④中抽滤得到的固体是?。
(4)抽滤装置主要由?、安全瓶、抽气泵和布氏漏斗四部分组成,该实验中抽滤时能否用滤纸?______(填“能”或“不能”), 理由是_____。
(5)从滤液⑤得到高锰酸钾的后续操作步骤是____。
参考答案:(1)AC;
(2)否,反应生成的高锰酸钾能被HCl还原,产生的氯气有毒,污染环境。
(3)二氧化锰。
(4)吸滤瓶,不能,因为高锰酸钾具有强氧化性,能腐蚀滤纸。
(5)蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
本题解析:(1)根据题给工艺流程图知,步骤①中有氢氧化钾参加反应,A、石英坩埚的成分为二氧化硅,C、瓷坩埚中含有二氧化硅,与氢氧化钾反应,不能选用,选AC;(2)结合题给信息和高锰酸钾和盐酸的性质分析。步骤③通CO2的目的是为了调节溶液的pH,不能改用氯化氢,原因是反应生成的高锰酸钾能被HCl还原,产生的氯气有毒,污染环境。(3)步骤④中抽滤得到的固体是二氧化锰。(4)抽滤装置主要由吸滤瓶、安全瓶、抽气泵和布氏漏斗四部分组成,该实验中抽滤时不能用滤纸,理由是因为高锰酸钾具有强氧化性,能腐蚀滤纸。(5)从滤液⑤得到高锰酸钾的后续操作步骤是蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
本题难度:一般