时间:2018-03-17 06:35:14
1、选择题 下列实验装置进行的相应实验,能达到实验目的的是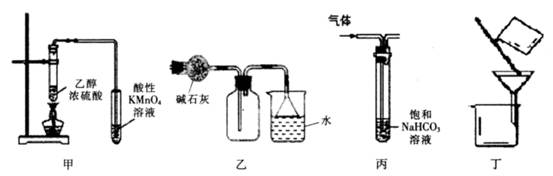
A.装置甲可用于检验有乙烯生成
B.装置乙可用于收集和吸收氨气
C.装置丙可用于除去CO2中混有的HCl气体
D.装置丁可用于除去溴苯中的溴
参考答案:C
本题解析:A、乙醇易挥发,且具有还原性,错误;B、氨气的密度小于空气,故应使用向下排空气法,错误;C、正确;D、溴苯与溴相互溶解,不能使用过滤方法分离,可以先加NaOH,振荡,分液。
本题难度:一般
2、选择题 某晶体由两种阳离子、一种阴离子和结晶水组成,取少量该晶体进行如下实验:
①将晶体置于试管中加热,试管口有液体生成;
②待试管冷却后,加水使固体全部溶解;
③向试管中逐滴加入 溶液至过量,同时加热,沉淀的物质的量先增多后减少,但最终仍有沉淀未溶解,在此过程中还有刺激性气味气体生成。
溶液至过量,同时加热,沉淀的物质的量先增多后减少,但最终仍有沉淀未溶解,在此过程中还有刺激性气味气体生成。
根据以上实验判断,该晶体是(?)
A.
B.
C.
D.
参考答案:B
本题解析:略
本题难度:简单
3、选择题 下列各组液体混合物中,能用分液漏斗分离的是(?)
A.淀粉溶液和食盐溶液
B.乙醇和水
C.苯和溴苯
D.苯和水
参考答案:D
本题解析:只有互不相溶液体之间才能用分液漏斗进行分离,苯不溶于水,其余都是易溶或互溶的,所以答案选D。
本题难度:简单
4、选择题 下列说法中正确的是( )
A.除去铜粉中混有的少量镁粉和铝粉可加入足量稀盐酸后过滤
B.可用酒精萃取碘水中的碘
C.除去Cl2中混有的少量HCl杂质可通入足量NaOH溶液
D.可用焰色反应鉴别K2CO3和Na2CO3
参考答案:A.镁、铝可与盐酸反应,而铜与盐酸不反应,则可用盐酸除杂,故A正确;
B.酒精与水混溶,应用苯或四氯化碳作为萃取剂,故B错误;
C.氯气和氯化氢与氢氧化钠都反应,应用饱和食盐水除杂,故C错误;
D.钾和钠的焰色反应现象不同,可用焰色反应鉴别,故D正确.
故选AD.
本题解析:
本题难度:一般
5、实验题 草酸亚铁晶体(FeC2O4·2H2O)呈淡黄色。某课题组为探究草酸业铁晶体的化学性质,?进行了一系列实验探究。
(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到二氧化碳气体生成。这说明草酸亚铁晶体具有?(填“氧化性”、“还原性”或“碱性”)。若反应中消耗1 mol FeC2O4·2H2O,则参加反应的KMnO4为?mol。
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体。课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三:
假设一:全部是FeO
假设二:?
假设三:?
(3)为验证上述假设一是否成立,课题组进行如下研究。
【定性研究】请你完成下表中内容。
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体,? ? ? | ? ? ? |

参考答案:(共1 5分)
(1)还原性(1分) ?0.6(2分)
(2)假设二:全部是Fe3O4(1分)?假设三:是FeO和Fe3O4的混合物(1分)
(3)【定性研究】(每空2分)
实验步骤:取少量黑色固体,加入适量稀盐酸(或稀硫酸)溶解,在溶液中加入KSCN溶液
预期实验现象和结论:若溶液不变红色,则假设一成立;若溶液变红色,则假设一不成立
【定量研究】
FeC2O4·2H2OFeO+CO↑+CO2↑+2H2O(或FeC2O4FeO+CO↑+CO2↑,3分)
不同意(1分),实验未在密闭容器中进行,FeO会被空气中的氧气进一步氧化,生成铁的其他氧化物(2分)
本题解析:
(1)高锰酸钾溶液的紫红色褪去,溶液变为棕黄色,很显然是FeC2O4被高锰酸钾氧化为Fe3+的结果,表明FeC2O4具有还原性。分析有关元素化合价的变化可知,反应过程中1 mol FeC2O4·2H2O可失去3 mol电子,而l mol KMnO4可得到5 mol电子:根据得失电子数相等的原则,反应中FeC2O4·2H2O与KMnO4的物质的量之比为5:3。因此,若反应中消耗1 mol FeC2O4·2H2O,则参加反应的KMnO4为3/5 mol。
(2)铁的氧化物中,呈黑色的有FeO和Fe3O4。
(3)【定性研究】FeO与盐酸或硫酸反应生成Fe2+,Fe2+与KSCN不反应。但Fe3O4或FeO和Fe3O4的混合物溶于稀盐酸或稀硫酸中生成Fe3+,遇KSCN变红色。据此即可设计方案进行验证。
【定量研究】草酸亚铁品体受热首先失去结品水,得到FeC2O4(即A点对应物质)。400℃时固体质量减少,应该是FeC2O4发生分解,牛成铁的氧化物(即B点对应物质)。根据图象可知1.0 g晶体分解生成的铁的氧化物的质量为0.4 g。设此铁的氧化物的化学式为FeaOb,根据Fe守恒可知0.4 g此氧化物中铁元素的质量为1.0 g× ,氧元素的质量为(0.4g—1.0 g×
,氧元素的质量为(0.4g—1.0 g× )g,故a:b="(1.0" g×
)g,故a:b="(1.0" g× ):(0.4g—1.0 g×
):(0.4g—1.0 g× ),解得a:b=1:1,即晶体分解所得铁的氧化物为FeO。至此不难写出草酸亚铁晶体分解的化学方程式为:FeC2O4·2H2OFeO+CO↑+CO2↑+2H2O(或FeC2O4FeO+CO↑+CO2↑)。此后,残留固体的质量逐渐增大,显然是被空气中的氧气所氧化,生成了铁的其他氧化物。由于坩埚是敞口容器,FeO会被空气中的氧气进一步氧化生成铁的其他氧化物,根据图象可知固体质量肯定会大于4.0 g。
),解得a:b=1:1,即晶体分解所得铁的氧化物为FeO。至此不难写出草酸亚铁晶体分解的化学方程式为:FeC2O4·2H2OFeO+CO↑+CO2↑+2H2O(或FeC2O4FeO+CO↑+CO2↑)。此后,残留固体的质量逐渐增大,显然是被空气中的氧气所氧化,生成了铁的其他氧化物。由于坩埚是敞口容器,FeO会被空气中的氧气进一步氧化生成铁的其他氧化物,根据图象可知固体质量肯定会大于4.0 g。
本题难度:一般