时间:2018-03-17 06:28:50
1、选择题 除去乙酸乙酯中含有的乙酸,最好的处理方法是( )
A.蒸馏
B.水洗后分液
C.用过量饱和碳酸钠溶液洗涤后分液
D.用过量氯化钠溶液洗涤后分液
参考答案:A、因酯和酸沸点相近而不易蒸馏分离,故A错误;
B、虽然乙酸能溶于水而除去,但乙酸乙酯也有部分溶于水,故B错误;
C、乙酸乙酯不溶于饱和碳酸钠溶液,乙酸的酸性比碳酸强,能与碳酸钠反应生成二氧化碳而被吸收,然后分液可得到纯净的乙酸乙酯,故C正确;
D、乙酸乙酯在氢氧化钠溶液中完全水解,反应方程式为CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH,故D错误;
故选:C.
本题解析:
本题难度:一般
2、填空题 (14分)茶是我国人民喜爱的饮品。某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有钙、铁、铝三种金属元素。
[查阅部分资料]:草酸铵[(NH4)2C2O4]属于弱电解质;草酸钙(CaC2O4)难溶于水;Ca2+、A13+、Fe3+完全沉淀的pH:Ca(OH)2:pH≥13;A1(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1。
试根据上述过程及信息填空:
(1)步骤②加盐酸的作用是? _________________________________________ ;
(2)写出检验Ca2+的离子方程式 ___________________________;
(3)写出沉淀C所含主要物质的化学式? _____________________________;
(4)写出步骤⑧用A试剂生成红色溶液的离子方程式_____________________________;
(5)步骤⑨的作用是?;
(6)猜测步骤⑩的目的是 _________________________________ ;
(7)已知:2Fe (s)+ 3/2O2 (g)= Fe2O3(s),△H = — Q1?kJ·mol-1
2Al(s) + 3/2O2 (g)= Al 2O3(s),△H = — Q2?kJ·mol-1
则Q1 ___________Q2(填“>”,“<”或“=”)?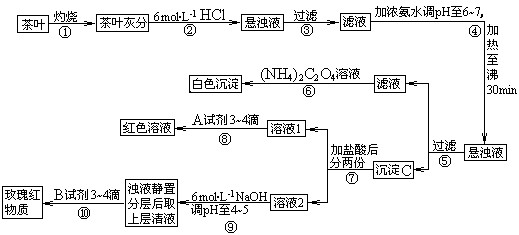
参考答案:(1)使茶叶灰分中的钙、铁、铝等难溶化合物转化成可溶性氯化物,使Ca2+、Al3+、Fe3+浸出(或使Ca2+、Al3+、Fe3+溶解)
(2)Ca2++(NH4)2C2O4=CaC2O4↓+2NH4+?(3)Fe(OH)3、Al(OH)3
(4)Fe3++3SCN Fe(SCN)3?(5)使Fe3+转化为Fe(OH)3沉淀,使之与铝元素分离
Fe(SCN)3?(5)使Fe3+转化为Fe(OH)3沉淀,使之与铝元素分离
(6)检验Al3+(或铝元素)存在?(7)<
本题解析:这样一条实验流程型的无机推断题经常会提供一些资料卡。资料中出现的内容是在解题过程中不可缺少的,这些知识在教科书上没有介绍过,但是基本原理并不复杂,学生可以通过阅读自学掌握。其中经常包含一些重要的解题信息。
本题给出的资料分为两部分,“草酸铵[(NH4)2C2O4]属于弱电解质;草酸钙[CaC2O4]难溶于水”是对问题(2)给出的信息,便于书写离子方程式时判断[(NH4)2C2O4]和[CaC2O4]均应以化学式出现;而另一部分信息“Ca2+、A13+、Fe3+完全沉淀的pH:Ca(OH)2:pH≥13;A1(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1”则是本题的突破口。
看到这个信息,到框图中寻找调节pH值的操作流程——④⑨,梳理实验是如何将三种金属离子分离开来的。④将pH值调节至6~7,此时铝离子和铁离子均已沉淀完全,而钙离子未沉淀完全,故沉淀C的成份是A1(OH)3和Fe(OH)3,滤液中有钙离子。⑨将pH值调节至4~5,此时铝离子没有沉淀而铁离子沉淀完全。这样这条题目的突破口就已经分析好了,解题思路基本有了眉目。
本题难度:一般
3、选择题 下列出去杂质的方法正确的是( )
A.除去CO2中混有的CO:用澄清的石灰水洗气
B.除去NaHCO3溶液中混有的Na2CO3:通入足量的二氧化碳
C.除去FeCl3溶液中混有的CuCl2:加入过量的铁粉过滤
D.除去BaCO3固体中混有的BaSO4:加入过量的盐酸、过滤、洗涤
参考答案:B
本题解析:
本题难度:一般
4、实验题 (15分)大理石中含有的主要杂质是氧化铁,以下是某化学兴趣小组用大理石为原料制取安全无毒杀菌剂过氧化钙的主要流程: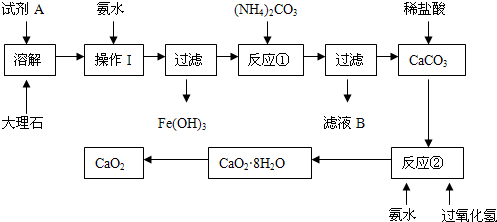
请回答下列问题:
(1)试剂A的名称是?;
(2)操作I的目的是?;
(3)本实验需要多次使用玻璃棒,则本实验过程中玻璃棒的作用有?;
(4)写出反应②中生成CaO2·8H2O的化学方程式:?;
(5)制得的CaO2中一般含有CaO该化学兴趣小组通过实验测定制得的样品中CaO2的含量:称量0.6g样品于锥形瓶中,然后加入过量的浓度为2.00mol?L-1的盐酸20.00mL,再用浓度为2.00mol?L-1的氢氧化钠溶液滴定锥形瓶中的溶液,消耗氢氧化钠溶液11.00mL.该样品中CaO2的质量分数为?。
参考答案:(1)硝酸或盐酸;?(2)调节溶液的pH,使Fe3+完全沉淀;(3)搅拌和引流;
(4)CaC12?+ H2O2?+ 2NH3?+ 8H2O ═ CaO2·8H2O↓ + 2NH4Cl?;(5)72%。
本题解析:CaCO3能与稀HCl或稀硝酸发生反应,转化为可溶性物质,而硫酸与CaCO3反应产生的硫酸钙微溶于水,使反应不能继续进行。而Fe2O3能与酸反应得到可溶性的铁盐,因此试剂A是硝酸或盐酸;(2)向其中加入氨水的目的是调节溶液的pH,使Fe3+完全沉淀;然后过滤除去。(3)本实验需要多次使用玻璃棒,则本实验过程中玻璃棒的作用有促进固体溶解的搅拌和为了分离难溶性固体与可溶性溶液的分离混合物的引流作用;(4)反应②中由CaCO3与H2O2?和氨水反应生成CaO2·8H2O的化学方程式是:CaC12?+ H2O2?+ 2NH3?+ 8H2O ═ CaO2·8H2O↓ + 2NH4Cl?;(5)n(HCl)= 2.00mol/L×0.02L=0.04mol。n(NaOH)=n(HCl)(过量)= 2.00mol/L×0.011L-0.022mol。因此样品产生的OH-的物质的量为0.018mol.。设样品中含有CaO2、CaO的物质的量分别x、y。则2x+2y=0.018mol;72x+56y=0.6g。解得x=0.006mol;y=0.003mol。所以该样品中CaO2的质量分数为[(0.006mol×72g/mol)÷0.6]×100%=72%。
本题难度:一般
5、选择题 能把Na2SO4、NH4NO3、KCl、(NH4)2SO4四瓶无色溶液加以区别的一种试剂是(? )
(必要时可以加热)?
A.BaCl2
B.NaOH
C.Ba(OH)2
D.AgNO3
参考答案:C
本题解析:略
本题难度:一般