时间:2018-03-17 06:27:44
1、选择题 有关晶体的下列说法中正确的组合是
①晶体中分子间作用力越大,分子越稳定?②.原子晶体中共价键越强,熔点越高
③冰熔化时水分子中共价键发生断裂?④.氯化钠熔化时离子键未被破坏
⑤熔化时无需破坏化学键的 晶体一定是分子晶体?⑥.元素周期表从ⅢB族到ⅡB族8个纵行的元素都是金属元素?⑦.在 SiO2和干冰晶体中,都存在单个分子
晶体一定是分子晶体?⑥.元素周期表从ⅢB族到ⅡB族8个纵行的元素都是金属元素?⑦.在 SiO2和干冰晶体中,都存在单个分子
⑧.分子晶体不都是共价化合物
A.①②⑤
B.②④⑤
C.②⑤⑧
D.①④⑦
参考答案:C
本题解析:略
本题难度:简单
2、填空题 ?【化学――选修物质结构与性质】(15分)
有A、B、C、D、E五种元素。其相关信息如下:
请回答下列问题。
(1) 写出E元素原子基态时的电子排布式__________________;
(2) C元素的第一电离能比氧元索的第一电离能 ______ ______ (填“大”或“小”);
(3) CA3分子中C原子的杂化轨道类型是____________;
(4) A、C、E三种元素可形成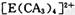 配离子,其中存在的化学键类型有 ______ (填序号);
配离子,其中存在的化学键类型有 ______ (填序号);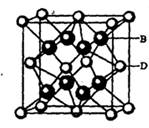
①配位键 ②金属键③极性共价键④非极性共价键⑤离子键 ⑥氢键
若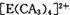 具有对称的空间构型,且当
具有对称的空间构型,且当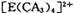 中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则
中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则 的空间构型为 ____________ (填序号);
的空间构型为 ____________ (填序号);
a.平面正方形b.正四面体c.三角锥型 ?d. V型
(5) B与D可形成离子化合物,其晶胞结构如右图所示。其中D离子的配位数为_____,若该晶体的密度为ag ? cm-3,则该晶胞的体积是______cm-3(写出表达式即可)。
参考答案:(1) 1s2 2s2 2p6 3s2 3p6 3d10 4s1或[Ar] 3d10 4s1(2)大(3)sp3(4)①③;a (5) 8;(4×78/ NAa) cm3.
本题解析:本题考查物质结构与性质的有关知识。根据A、B、C、D、E五种元素的相关信息,可以推断出A、B、C、D、E五种元素分别是H、F、N、Ca、Cu。(1) Cu的基态电子排布式为1s2 2s2 2p6 3s2 3p6 3d10 4s1或[Ar] 3d10 4s1(2)由于N的P电子满足洪特规则,能量降低,第一电离能升高,故N元素的第一电离能比氧元索的第一电离能大。(3)NH3中氮原子最外层有5个电子,与氢共用3个电子,达8电子结构。根据价层电子对互斥理论,四对电子的排布方式为四面体构形,根据杂化轨道理论,应为sp3杂化。(4)[Cu(NH3)4]2+中Cu与NH3通过配位键结合,NH3中N与H通过极性共价键结合。由于[Cu(NH3)4]2+是对称结构,且两个NH3被两个Cl-取代时,能得到两种不同结构的产物。如果[Cu(NH3)4]2+是正四面体结构,两个NH3被两个Cl-取代时,能得到一种产物,不合题意,故[Cu(NH3)4]2+是平面正方形结构。(5)F与Ca形成CaF2,从晶体结构可以看出,氟化钙结构又称萤石型结构,属等轴晶系,面心立方结构。氟化钙是AB2型离子晶体。其中阳离子A(Ca2+)呈立方密堆积,阴离子B(F-)填充在四面体空隙中,面心立方点阵对角线的1/4和3/4处。阴、阳离子的配位数分别为4和8。阳、阴离子半径比R2+/R->0.732。,所以一个氟化钙晶体中有4个氟化钙。该晶体的密度为ag ? cm-3,则该晶胞的体积是(4×78/ NAa) cm3。
本题难度:一般
3、选择题 下表列出了有关晶体的说明,有错误的是
参考答案:D
本题解析:
本题较容易,学生应熟记:原子晶体,离子晶体,分子晶体,金属晶体,石墨晶体等常考类型的相关知识。
D:SiO2为原子晶体,没有分子存在;是由Si和O原子通过共价键按1:2形成的。
本题难度:一般
4、填空题 【二选一—物质结构与性质】
碳、氧、铁、铜等是与人类生产、生活息息相关的化学元素。
(1)基态铜原子的价电子排布式为___________,铜原子的电子占有___________种能量不同的原子轨道。
(2)CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO分子中C原子的杂化类型为___________杂化。
(3)甲烷和四氯化碳具有相似的空间结构,但常温下甲烷是气体,四氯化碳是液体,其原因是________________?。
(4)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据。 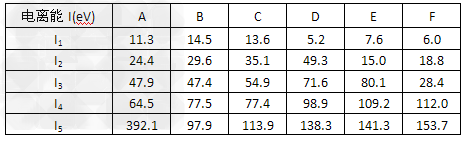
请回答:
表中的金属元素是_____________(填字母)。若A、B、C依次为同周期相邻元素,表中显示B比A和C的第一电离能都略大,其原因是______________。 ?
(5)元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,现象是_____________?;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为_______________。
(6)在一定条件下铁形成的晶体的基本结构单元如下图1和图2所示,则图1和图2的结构中铁原子的配位数之比为____________。 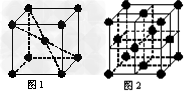
参考答案:(1)[Ar]?3d104s1;?7
(2)sp
(3)甲烷和四氯化碳均为分子晶体,而四氯化碳的相对分子质量比甲烷的相对分子质量大,四氯化碳分子间作用力比甲烷分子间作用力强,四氯化碳的沸点比甲烷高,故常温下甲烷是气体,四氯化碳是液体。
(4)D?E?F; B的np轨道上的电子半满,能量比A和C低,第一电离能比A和C大
(5)产生白色沉淀;?[Co?(NH3)5SO4]Br?
(6)2∶3
本题解析:
本题难度:一般
5、选择题
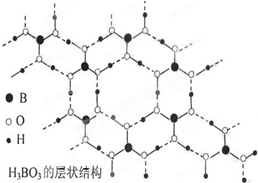
正硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子之间通过氢键相连(层状结构如图所示,图中“虚线”表示氢键).下列有关说法正确的是( )
参考答案:B
本题解析:
本题难度:简单