时间:2018-03-17 06:26:36
1、填空题 某课外活动小组利用如图所示装置制取氯气。提供的试剂有:浓盐酸、饱和食盐水、氢氧化钠溶液、高锰酸钾固体。反应的化学方程式为:
2KMnO4 + 16HCl(浓)= 2KCl + 2MnCl2 + 5Cl2?↑+ 8H?2O
试回答下列问题:
(1)在反应2KMnO4 + 16HCl(浓)= 2KCl + 2MnCl2 + 5Cl2↑+ 8H2O中,HCl体现的性质为________和_________.当生成的Cl2的体积5.6L(标准状况下),求转移的电子的个数________(阿伏伽德罗常数用NA来表示)
(2)装置H中盛放的试剂是?。装置P中盛放的试剂是?。
(3)尾气处理时关闭弹簧夹a和弹簧夹?,打开弹簧夹?。
(4)处理尾气时,发生反应的离子方程式为?。
参考答案:(b和c各1分,其余皆为2分,共14分)
(1)酸性和还原性,0.5NA,?(2)饱和食盐水,氢氧化钠溶液
(3)b? c?(4)Cl2+2OH-=Cl-+ClO-+H2O
本题解析:(1)在反应中,氯元素的化合价从-1价升高到0价,所以体现氯化氢的还原性。但同时还有氯化锰生成,体现氯化氢的酸性。生成氯气的物质的量是5.6L÷22.4L/mol=0.25mol,所以在反应中转移电子的物质的量是0.25mol×2=0.5mol,则转移的电子的个数是0.5NA。
(2)由于氯气能溶于水,所以可以用排饱和食盐水法收集氯气,则H中盛放的是饱和食盐水。
(3)P中盛放的氢氧化钠溶液,用来处理尾气,所以尾气处理时关闭弹簧夹a和弹簧夹b,打开弹簧夹c。
(4)氯气和氢氧化钠溶液反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O。
点评:该题是高考中的常见题型,属于中等难度的试题,试题综合性强,难易适中。在注重对学生基础性知识考查和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生的严谨规范的实验设计能力,也有利于提高学生的学科素养。该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。
本题难度:一般
2、计算题 实验欲配制6.00 mol/L的H2SO4溶液.现有三种不同浓度的硫酸:①240 mL 1.00 mol/L的硫酸;②150 mL 25.0%的硫酸(ρ=1.18 g/mL);③足量的18.00 mol/L的浓H2SO4.现有三种规格容量瓶:250 mL、500 mL、1000 mL.配制要求:①、②两种硫酸全部用完,不足部分由③补充.试回答:
(1)选用容量瓶的规格是?。
(2)需要18.0 mol·L-1 H2SO4(aq)的体积是?。
参考答案:(1)1000 mL (2)295 mL
本题解析:(1)①25.0%的H2SO4溶液的物质的量浓度为:
c2(H2SO4)=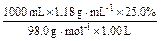 =3.01 mol·L-1
=3.01 mol·L-1
①、②两溶液的体积和约为:
V1+V2=240 mL+150 mL=390 mL
因①、②两溶液的浓度都小于6.00 mol·L-1,所以250 mL的容量瓶不可用。
②设配制500 mL 6.00 mol·L-1H2SO4(aq)需浓H2SO4的体积为x,则
0.500 L×6.00 mol·L-1=0.240 L×1.00 mol·L-1+0.150 L×3.01 mol·L-1+x×10-3 L×18.0 mol·L-1
解得:x=128
因为:128+240+150=518>500
所以,500 mL容量瓶也不能用.
(2)设配制1000 mL 6.00 mol·L-1 H2SO4(aq)需浓H2SO4的体积为y,则:1.000 L×6.00 mol·L-1=0.240 L×1.00 mol·L-1+0.150 L×3.01 mol·L-1+y×10-3 L×18.0 mol·L-1
解得:y=295 mL。
本题难度:简单
3、简答题 课题式课堂教学是研究性学习的一种方式,其基本教学模式为:
如图是关于‘‘一氧化碳的化学性质”的课题式课堂教学中解决问题阶段,甲同学设计的证明CO具有还原性的实验装置.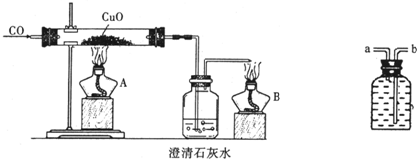
(1)实验时应先点燃______处(填“A”或“B”)的酒精灯.
(2)硬质试管中反应的化学方程式为______.
(3)乙同学认为甲装置有待优化,如尾气可先储存在瓶内,然后再处理.如上图是他设计的贮气瓶,尾气应从______(选填“a”或“b”)口通入(其它装置略).
(4)丙同学质疑:CO能否使澄清石灰水变浑浊?因此,他设计在CO通入CuO之前,应先通入澄清石灰水,以比较排除CO与澄清石灰水反应,试对此作出评价.你认为丙的设计是否有必要:______,理由是______.
(5)如果开始时通入的是CO和CO2的混合气体,则应如何设计才能达到实验目的?______.
参考答案:(1)一氧化碳还原氧化铜的步骤是先通入一氧化碳排净装置内空气防止爆炸,所以有一氧化碳通过就要点燃B处酒精灯,防止一氧化碳污染空气;
故答案为:B;
(2)硬质试管中是一氧化碳在加热条件下和氧化铜反应生成铜和二氧化碳,反应的化学方程式为:CuO+CO?△?.?Cu+CO2 ;
故答案为:CuO+CO?△?.?Cu+CO2;
(3)采用乙装置进行储气时,由于气体要留在集气瓶中,而水被排出,所以气体一定要从a管通入,否则无法达到储气的目的;
故答案为:a;
(4)由于一氧化碳能燃烧,所以点燃或加热前一定不能混入氧气,否则有可能产生爆炸,因此在进行实验时应先给装置通一会一氧化碳,从而排净装置内的空气,所以此时就可以通过A装置内石灰水的变化判断一氧化碳是否能与石灰水反应,因此完全没有必要再加装置进行实验,故答案为:不必要;?在酒精灯A点燃前,CO已通过了澄清石灰水;
(5)如果开始时通入的是CO和CO2的混合气体,二氧化碳气体会干扰实验检验;先通过碱石灰除去CO2后再通入装置;
故答案为:先通过碱石灰除去CO2后再通入装置;
本题解析:
本题难度:一般
4、实验题 已知某混合金属粉末,除铝外还含有铁、铜中的一种或两种,所含金属的量都在5%以上。请设计合理实验探究该混合金属粉末中铁、铜元素的存在。
仅限选择的仪器和试剂:烧杯、试管、玻璃棒、量筒、容量瓶、滴管、药匙;1 mol/L硫酸、2 mol/L
硝酸、2 mol/L NaOH溶液、20% KSCN溶液。
完成以下实验探究过程:
(1)提出假设:
假设1:该混合金属粉末中除铝外还含有_________元素;
假设2:该混合金属粉末中除铝外还含有_________元素;
假设3:该混合金属粉末中除铝外还含有Fe、Cu元素;
(2)设计实验方案基于假设3,设计出实验方案(不需要作答)。
(3)实验过程根据(2)的实验方案,叙述实验操作、预期现象和结论。 
参考答案:(1)Cu;Fe(3)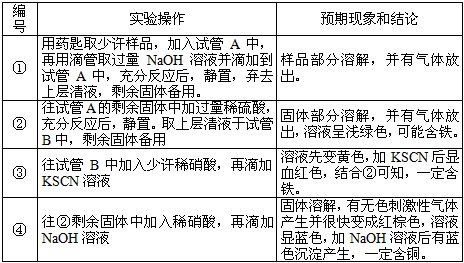
本题解析:
本题难度:一般
5、选择题 下列与实验相关的叙述正确的是
A.稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中
B.配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出
C.从碘水中提取单质碘时,不能用无水乙醇代替CCl4
D.检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸
参考答案:C
本题解析:A:为避免稀释浓硫酸时放出的大量热引起液体飞溅,应将浓硫酸沿玻璃棒引流至水中,并不断搅拌,不正确
B:配制溶液时,若加水超过容量瓶刻度,应重新配制,不正确
C:正确
D:应先用盐酸酸化后,再滴加BaCl2溶液,不正确
答案为C
本题难度:一般