时间:2018-03-17 06:20:46
1、选择题 已知常温下:Ksp〔Mg(OH)2〕=1.2×10-11mol3·L-3 Ksp(AgCl)=1.8×10-10mol2·L-2 Ksp(Ag2CrO4)=
1.9×10-12 mol3·L-3,Ksp(CH3COOAg)=2.3×10-3mol2·L-2下列叙述正确的是
[? ]
A.等体积混合浓度均为0.2 mol·L-1的AgNO3溶液和CH3COONa溶液一定产生CH3COOAg沉淀
B.将0.001 mol·L-1的AgNO3溶液滴入0.001 mol·L-1的KCl和0.001 mol·L-1的K2CrO4溶液中先产生Ag2CrO4沉淀
C.在Mg2+为0.121 mol·L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH至少要控制在9以上
D.向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)变大
参考答案:AC
本题解析:
本题难度:一般
2、选择题 下列有关物质的性质或应用说法正确的是( )
A.糖类、油脂、蛋白质在一定条件下均可以水解
B.医疗上可用BaCO3作X射线透视肠胃的内服药剂
C.从海水中得到氯化镁晶体,电解氯化镁晶体可获得金属Mg
D.锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去
参考答案:A、糖类分单糖、二糖和多糖,单糖不水解,二糖、多糖、油脂、蛋白质在一定条件下均可以水解,故A错误.
B、碳酸钡是弱酸盐,能和盐酸反应,但硫酸钡既不和酸反应也不和碱反应,所以医疗上可用BaSO4作X射线透视肠胃的内服药剂,故B错误.
C、镁是活泼金属,所以镁的冶炼方法是电解氯化镁,但必须是电解熔融态的氯化镁不是氯化镁晶体,故C错误.
D、硫酸钙是微溶性的物质,能和碳酸钠反应生成难溶性的碳酸钙,碳酸钙和盐酸能反应,所以锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去,故D正确.
故选D.
本题解析:
本题难度:一般
3、选择题 在一个绝热容器中,放入Ca(OH)2悬浊液,有平衡:Ca(OH)2(s)?Ca2+(aq)+2OH-(aq)△H<0.已知:CaO(s)+H2O(l)═Ca(OH)2(s)△H<0.下列说法正确的是( )
A.向溶液中加少量CaO,达新平衡后,溶液的pH不变
B.向溶液中加少量CaO,达新平衡后,溶液的pH降低
C.向溶液中加入Na2CO3溶液,其中Ca(OH)2固体质量增加
D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
参考答案:A.向饱和石灰水中加少量生石灰后不仅消耗水,溶液的温度也升高,氢氧化钙的溶解度随着温度的升高而降低,溶液中氢氧根离子浓度越小,溶液的pH越小,故A错误;
B.向饱和石灰水中加少量生石灰后不仅消耗水,溶液的温度也升高,氢氧化钙的溶度积越小,则溶液中氢氧根离子浓度越小,溶液的pH越小,故B正确;
C.向溶液中加入Na2CO3溶液,钙离子和碳酸根离子形成碳酸钙沉淀,Ca(OH)2(s)?Ca2+(aq)+2OH-(aq)△H<0,平衡正向进行,其中Ca(OH)2固体质量减小,故C错误;
D.向溶液中加入少量NaOH固体,溶液中氢氧根离子浓度增大,Ca(OH)2(s)?Ca2+(aq)+2OH-(aq)△H<0,平衡逆向进行,Ca(OH)2固体质量增大,故D错误;
故选B.
本题解析:
本题难度:简单
4、选择题 已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2-的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是(?)
A.Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O
B.Cu2++H2S=CuS↓+2H+
C.Zn2++S2-+2H2O=Zn(OH)2↓+H2S↑
D.FeS+2H+=Fe2++H2S↑
参考答案:C
本题解析:因为MgCO3的溶解度大于Mg(OH)2的,所以会形成Mg(OH)2,A正确;H2S电离生成S2-的能力大于CuS的,小于FeS的,所以H2S与Cu2+反应生成更难电离的CuS,FeS与H+反应生成更难电离的H2S,B、D正确;依溶解度Zn(OH)2>ZnS,可知应该生成难溶的ZnS,C错误。
本题难度:简单
5、填空题 (16分)氨气是一种重要的化工产品及工业原料。
I.某温度下,合成氨反应的平衡常数K=3.0×103(mol/L)-1,
(1)写出其对应的化学方程式____________________________________________________ 。
(2)某温度下,如果在体积恒定为10L的密闭容器中充入:0.1molN2、0.1molH2和2molNH3则反应_______(填“正向进行”或“逆向进行”或“达到平衡”)。
(3)该温度下,在体积恒定为10L的四个密闭容器中分别充入下列物质,反应达到平衡后,N2的转化率最大的是___________________。
a.10molN2、30molH2和20molNH3 b.10molN2和30molH2
c.20molN2和60molH2 d.10molN2和28molH2
II.氨气极易溶于水,氨水是氨气溶于水而形成的溶液,回答下列问题:
(4)在氨水溶液中加水稀释的过程,NH3·H2O的电离程度___________(填“增大”“减小”或“不变”),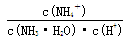 ___________(同上)。
___________(同上)。
(5)室温下,a mol/L的(NH4)2SO4水溶液的pH=5,原因是溶液中存在平衡________________________(用离子方程式表示)。并计算该平衡的平衡常数表达式为________________________(用含代数a的较为精确的数学表达式表示,不必化简,不做近似运算)。
(6)室温下,向浓度均为0.1mol/L的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为_________________________________________。
(已知:室温时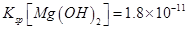 mol3
mol3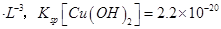 mol3.L-3).
mol3.L-3).
参考答案:Ⅰ. (1)1/2 N2 + 3/2 H2 NH3(2分) (2)正向进行(2分) (3)c(2分)
NH3(2分) (2)正向进行(2分) (3)c(2分)
Ⅱ.(4)增大(1分) 不变 (2分)
(5)NH4++H2O NH3?H2O+H+(2分) 10-5(10-5-10-9)/2a+10-9-10-5 mol·L-1(2分)
NH3?H2O+H+(2分) 10-5(10-5-10-9)/2a+10-9-10-5 mol·L-1(2分)
(6)Cu(OH)2(1分) Cu2++2NH3·H2O=Cu(OH)2 ↓+2NH4+(2分)
本题解析:(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则根据平衡常数可知反应的化学方程式为1/2 N2 + 3/2 H2 NH3。
NH3。
(2)在体积恒定为10L的密闭容器中充入:0.1molN2、0.1molH2和2molNH3则产生浓度熵为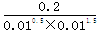 =2000<3000,所以反应向正反应方向进行。
=2000<3000,所以反应向正反应方向进行。
(3)a与b相比,a中含有大量的氨气,因此b中氨气的转化率大于a中。b与d相比,b中氢气浓度大,大转化率高;由于正方应是体积减小的可逆反应,所以增大压强平衡向正反应方向进行,c与b相比,相当于是在b的基础上增大压强,氮气转化率增大,答案选c。
(4)稀释促进氨水的电离,电离程度增大。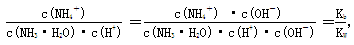 ,因此比值不变。
,因此比值不变。
(5)铵根水解溶液显酸性,方程式为NH4++H2O NH3?H2O+H+。室温下,在a mol?L-1的(NH4)2SO4水溶液中pH=5,溶液中c(H+)=10-5mol/L,故溶液中c(OH-)=10-9mol/L,根据电荷守恒有:c(NH4+)+c(H+)=c(OH-)+2c(SO42-),即c(NH4+)+10-5mol/L=10-9mol/L+2amol/L,则c(NH4+)=(2a+10-9-10-5)mol/L,根据物料守恒计算溶液中c(NH3?H2O)=2amol/L-(2a+10-9-10-5)mol/L=(10-5-10-9)mol/L,故NH4++H2O
NH3?H2O+H+。室温下,在a mol?L-1的(NH4)2SO4水溶液中pH=5,溶液中c(H+)=10-5mol/L,故溶液中c(OH-)=10-9mol/L,根据电荷守恒有:c(NH4+)+c(H+)=c(OH-)+2c(SO42-),即c(NH4+)+10-5mol/L=10-9mol/L+2amol/L,则c(NH4+)=(2a+10-9-10-5)mol/L,根据物料守恒计算溶液中c(NH3?H2O)=2amol/L-(2a+10-9-10-5)mol/L=(10-5-10-9)mol/L,故NH4++H2O NH3?H2O+H+的平衡常数的表达式为
NH3?H2O+H+的平衡常数的表达式为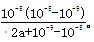 。
。
(6)溶度积常数越小的物质越先沉淀,氢氧化铜的溶度积小于氢氧化镁的溶度积,所以氢氧化铜先沉淀,铜离子和氨水反应生成氢氧化铜沉淀和铵根离子,离子方程式为Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+。
考点:考查平衡常数计算与应用、外界条件对电离平衡的影响、盐类水解以及溶度积常数应用等
本题难度:困难