时间:2018-03-17 06:13:26
1、选择题 MCFC型燃料电池可同时供应电和水蒸气,其工作温度为600?-700?,所用燃料为H2,电解质为熔融的K2CO3.已知该电池的总反应为2H2+O2═2H2O,则下列有关该电池的说法正确的是( )
A.该电池的正极的反应式为:4OH-+4e-═O2+2H2O
B.该电池负极的反应为:H2+CO32--2e-═H2O+CO2
C.放电时CO32-向正极移动
D.该燃料电池能量转化率很低
参考答案:A.该燃料电池燃料为H2,电解质为熔融的K2CO3总反应为2H2+O2=2H2O,负极反应为2H2+2CO32--4e-═2H2O+2CO2,用总反应减负极得正极反应式:O2+2CO2+4e-═2CO32-,故A错误;
B.根据原电池的工作原理:负极是燃料发生氧化反应,即2H2+2CO32--4e-═2H2O+2CO2,故B正确;
C、原电池中阴离子向负极移动,故C错误;
D、燃料电池能量转化率较高,故D错误.
故选B.
本题解析:
本题难度:一般
2、选择题 在理论上不能用于设计原电池的化学反应是
[? ]
A.HCl(aq)+ NaOH(aq)=== NaCl(aq)+ H2O(l) △H < 0
B.2CH3OH(l)+3O2(g)=== 2CO2(g)+ 4H2O(l) △H < 0
C.Zn(s)+CuSO4(aq)=== ZnSO4(aq)+Cu(s) △H < 0
D.2H2(g)+ O2(g)=== 2H2O(l) △H < 0
参考答案:A
本题解析:
本题难度:简单
3、选择题 一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是
[? ]
参考答案:C
本题解析:
本题难度:一般
4、选择题 有关如图所示原电池(盐桥中装有含琼胶的KCl饱和溶液)的叙述,不正确的是( )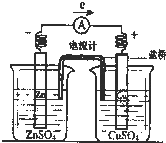
A.铜片上有红色物质附着
B.取出盐桥后,电流计依然发生偏转
C.反应中,盐桥中的K+会移向CuSO4溶液
D.锌片上发生氧化反应
参考答案:A.Cu为正极,发生还原反 应Cu2++2e-═Cu,析出Cu附着在Cu电极上,铜片质量增加,故A正确;
B.取出盐桥后,不是闭合回路,没有电流产生,电流计不发生偏转,故B错误;
C.原电池工作时,阳离子向正极移动,阴离子向负极移动,盐桥中的K+会移向CuSO4溶液,故C正确;
D.Zn为负极,发生氧化反应Zn-2e-═Zn2+,故D正确.
故选:B.
本题解析:
本题难度:一般
5、填空题 (12分)熔融盐燃料电池具有较高的发电效率,因而受到重视。某燃料电池以熔融的K2CO3(其中不含O2-和HCO-3)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池负极电极反应式为:2C4H10+26 CO32--52e-===34CO2+10H2O。
试回答下列问题:
(1)该燃料电池中发生氧化反应的物质是 。
(2)该燃料电池的化学反应方程式为 ;
(3)某学生想用该燃料电池电解饱和食盐水,写出反应的离子方程式 。
(4)当电路中通过0.26NA的电子时,消耗的氧气的体积(标况)为 ;此时电解饱和食盐水生成的氯气的物质的量是 ;若此时溶液体积为200ml,则生成的NaOH的物质的量浓度为 。
参考答案:(1) C4H10 (2)2C4H10+13O2===8CO2+10H2O
(3)2Cl-+2H2O=====电解Cl2↑+H2↑+2OH-
(4)1.456 0.13mol 1.3Mol/L
本题解析:(1)原电池中负极失去电子,正极得到电子,所以该燃料电池中发生氧化反应的物质是C4H10;(2)原电池中负极失去电子,正极得到电子,所以丁烷在负极通入,氧气在正极通入,所以总反应式为2C4H10+13O2=8CO2+10H2O。(3)电解饱和食盐水得到氯气、氢气、氢氧化钠,反应的离子方程式为2Cl-+2H2O Cl2↑+H2↑+2OH-(4)0.26NA的电子的物质的量为0.26mol,根据正极反应式O2+2CO2+4e-=2CO32-可知,消耗的氧气的物质的量为0.065mol, 体积(标况)为1.456L;根据2Cl--2 e-= Cl2↑,通过0.26mol电子,生成的氯气的物质的量是0.13mol;生成0.13mol氯气的同时生成NaOH0.26mol,物质的量浓度为1.3mol/L。
Cl2↑+H2↑+2OH-(4)0.26NA的电子的物质的量为0.26mol,根据正极反应式O2+2CO2+4e-=2CO32-可知,消耗的氧气的物质的量为0.065mol, 体积(标况)为1.456L;根据2Cl--2 e-= Cl2↑,通过0.26mol电子,生成的氯气的物质的量是0.13mol;生成0.13mol氯气的同时生成NaOH0.26mol,物质的量浓度为1.3mol/L。
考点:考查原电池、电解池原理及有关计算。
本题难度:一般