时间:2018-03-17 06:13:05
1、选择题 下列说法中,不正确的是(? )
A.NH3的水溶液可以导电,说明NH3是电解质
B.明矾水解形成Al(OH)3胶体有吸附性,可用于水的净化
C.二氧化硅可用于制造光导纤维
D.向淀粉碘化钾溶液中加溴水,溶液变为蓝色,说明Br2的氧化性强于I2
2、选择题 下列各组大小顺序不正确的是
A.酸性:H2SiO3<H3PO4<H2SO4<HClO4
B.热稳定性:SiH4<PH4<H2S<HCl
C.金属的还原性:Na<Mg<Al
D.还原性:HF<HCl<HBr<HI
3、选择题 能够说明硫的非金属性比氯弱的事实有
[? ]
4、填空题 某同学设计了一套实验方案研究第11-18号部分元素的性质变化 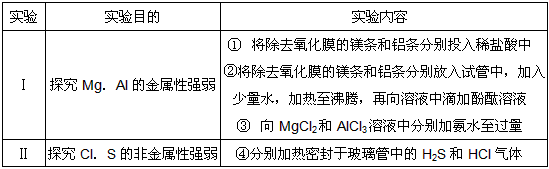
(1)指出②中的实验现象:_______________________
(2)实验Ⅰ的设计中能达到实验目的的实验项目是___________(填序号)
(3)写出③中发生反应的离子方程式:______________________?
(4)④中密封油H2S的玻璃管加热后出现黄色固体,分析产生这种现象的原因是:_________________。密封有HCl的玻璃管无明显现象。该实验说明非金属性:S_______Cl(填“强于”或“弱于”)
5、选择题 ?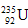 是重要的核工业原料,在自然界的丰度很低。
是重要的核工业原料,在自然界的丰度很低。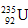 的浓缩一直为国际社会关注。下列有关
的浓缩一直为国际社会关注。下列有关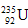 说法正确的是
说法正确的是
[? ]
A.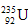 原子核中含有92个中子?
原子核中含有92个中子?
B.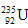 原子核外有143个电子?
原子核外有143个电子?
C.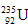 与
与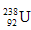 互为同素异形体?
互为同素异形体?
D.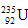 与
与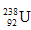 互为同位素
互为同位素