时间:2018-03-17 05:41:09
1、选择题 对室温下pH相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是?
[? ]
A.加适量的醋酸钠晶体后,两溶液的pH均增大
B.使温度都升高20℃,两溶液的pH均不变
C.加水稀释2倍后,两溶液的pH均减小
D.加足量的锌充分反应后,两溶液中产生的氢气一样多
参考答案:A
本题解析:
本题难度:一般
2、选择题 下列说法正确的是
A.用乙醇或CCl4可提取碘水中的碘单质
B.NaCl溶液能导电是因为溶液中有自由移动的Na+ 和Cl-
C.H2SO4在电流作用下在水中电离出H+和SO42-
D.液态HCl,固态NaCl均不导电,所以HCl、NaCl都不是电解质
参考答案:B
本题解析:略
本题难度:简单
3、选择题 如图所示为电解质溶液的PH随外界条件T变化的图象,下列的叙述不正确的是( )
A.若T代表温度,Na2CO3溶液符合曲线a的变化
B.若T代表温度,醋酸稀溶液符合曲线d的变化
C.若T代表温度,明矾溶液符合曲线c的变化
D.若T代表加入水的量,氨水符合曲线b的变化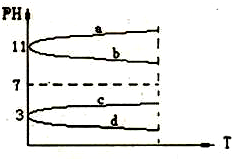
参考答案:C
本题解析:
本题难度:简单
4、填空题 已知H2B在水溶液中存在以下电离:
一级电离:H2B
H++HB-,二级电离:HB-
H++B2-
请回答以下问题:
(1)NaHB溶液______(填“呈酸性”、“呈碱性”或“无法确定”),原因是______.
(2)若0.1mol-L-1的H2B溶液在某温度下的pH=3,c(B2-)=1×10-6mol-L-1,则H2B的一级电离的电离度为______.
(3)某温度下,在0.1mol-L-1的NaHB溶液中,以下关系一定不正确的是______
A.c(H+)-c(OH-)=1×10-14
B.pH>1
C.c(OH-)=2c(H2B)+c(HB-)+c(H+)
D.c(Na+)=0.1mol-L-1≥c(B2-)
(4)某温度下,FeB(s)
Fe2+(aq)+B2-(aq)的平衡常数表达式为KSP=c(Fe2+)-c(B2-),FeB在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是______
A.a点对应的KSP等于b点对应的KSP
B.d点无沉淀生成
C.可以通过升温实现由c点变到a点
D.此温度下,KSP=4×10-18.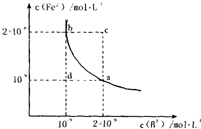
参考答案:(1)HB-在水溶液中存在电离平衡和水解平衡两种,以电离为主时,溶液显酸性,以水解为主时,溶液显碱性,所以无法确定NaHB溶液的酸碱性,
故答案为:无法确定;NaHB溶液中同时存在HBˉ
H++B2-,HBˉ+H2O
H2B+OHˉ,因两个平衡程度无法确定,故难以确定溶液酸碱性;
(2)H2B溶液的一级电离为:H2B
H++HB-,二级电离为:HB-
H++B2-,c(B2-)=1×10-6mol?L-1,所以二级电离出的氢离子浓度为1×10-6mol?L-1,所以一级电离生成的氢离子浓度为1×10-3mol?L-1-1×10-6mol?L-1≈1×10-3mol?L-1,所以电离度=1×10-3mol/L0.1mol/L×100%=1%,故答案为:1%;
(3)A、常温下,任何溶液中离子积表达式Kw=c(H+)?c(OH-)=1×10-14均成立,故A正确;
B、NaHB溶液中弱离子不能完全电离,所以0.1mol?L-1的NaHB溶液中氢离子浓度小于0.1mol/L,pH>1,故B正确;
C、根据0.1mol?L-1的NaHB溶液中的质子守恒c(OH-)=c(H2B)-c(B2-)+c(H+),故C错误;
D、c(Na+)=0.1mol?L-1,B2-离子是弱离子水解出来的,一定比钠离子浓度小,故D错误.
故选CD;
(4)A、a、b两点均是平衡状态的点,所以a点对应的KSP等于b点对应的KSP,故A正确;
B、d点的Qc小于KSP,所以无沉淀生成,故B正确;
C、c点Qc大于KSP,升温,沉淀溶解平衡向右移动导致Qc更大,不会到a点,故C错误;
D、取平衡态下的任何一点a点,此温度下,KSP=2×10-9×10-9=2×10-18,故D错误.
故选CD.
本题解析:
本题难度:一般
5、选择题 pH相同的醋酸溶液和盐酸,分别用蒸馏水稀释至原体积的m倍和n倍,稀释后两溶液pH仍相同,则m和n的关系是( )
A.m=n
B.m>n
C.m<n
D.无法判断
参考答案:B
本题解析:因弱电解质在稀释过程中电离程度增大,故稀释相同倍数,醋酸的pH小一点;先相同,故醋酸稀释的倍数多。答案选B。
本题难度:一般