时间:2018-03-17 05:38:34
1、选择题 氯化硼(BCl3)的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120°,它能与水反应。下列有关叙述中正确的是( )
A.氯化硼液态时能导电而固态时不导电
B.将氯化硼加到水中会使溶液的PH降低
C.氯化硼分子为三角锥形
D.氯化硼晶体为分子晶体,不溶于水
参考答案:B
本题解析:A项:氯化硼是共价化合物液态时不能导电,故错;C项:三氯化硼中的硼为sp2杂化,无孤对电子,分子中键与键之间的夹角为120°,是平面三角形结构,故错;D项:三氯化硼水解生成的HCl在空气中形成白雾,故错。故选B。
点评:本题考查原子轨道杂化,分子立体构型等,难度适中,注意三氯化硼中的硼为sp2杂化,无孤对电子,分子中键与键之间的夹角为120°,是平面三角形结构。
本题难度:一般
2、填空题 已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B是所有元素中电负性最大的元素。B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第6列元素。D的原子序数比E小4,D跟B可形成离子化合物其晶胞结构如图。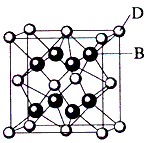
请回答:
(1)A元素单质的电子式是____________;
(2)B单质的分子式为____________,C的元素符号是____________。B与A形成的化合物比C 与A形成的化合物沸点高,其原因是________________________
(3)E属元素周期表中第______周期,第_______族的元素,名称是____________。它的基态原子的电子排布式为____________
(4)从图中可以看出,D跟B形成了离子化合物,请用电子式表示该离子化合物的形成过程________________________;该离子化合物晶体的密度为ag·cm-3,则晶胞的体积是____________(只要求列出算式)。
参考答案:(1)H:H
(2)F2;HCl;氟化氢分子间存在氢键,而氯化氢分子间没有氢键
(3)四;VIIB;铬;1s22s22p63s23p63d54s1
(4) ;
;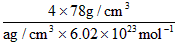
本题解析:
本题难度:一般
3、选择题 下图是氯化铯晶体的晶胞结构示意图(晶胞是指晶体中最小的重复单元),其中黑球表示氯离子、白球表示铯离子。已知晶体中2个最近的铯离子的核间距离为acm,氯化铯的摩尔质量为Mg/mol,则氯化铯晶体的密度为 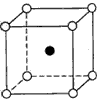
[? ]
A.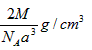
B.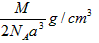
C.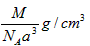
D.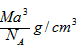
参考答案:C
本题解析:
本题难度:一般
4、选择题 有关晶体的下列说法中正确的是(?)
A.分子晶体中分子间作用力越大,分子越稳定
B.原子晶体中共价键越强,熔点越高
C.金属晶体发生形变时,金属键发生断裂
D.氯化钠熔化时离子键未被破坏
参考答案:B
本题解析:A.分子间作用力一般只与物质的物理性质,例如溶沸点有关系,不正确
B.正确
C.金属晶体发生形变时,金属键并不断裂
D.氯化钠熔化的同时离子键断裂
答案为B
本题难度:简单
5、选择题 .某晶体中含有A、B、C三种元素,其排列方式如图所示,C在体中心晶体中A、B、C的原子个数之比依次为( )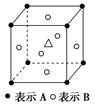
A.1∶3∶1? B.2∶3∶1? C.8∶6∶1? D.4∶3∶1
参考答案:A
本题解析:A为8×1/8=1、B为6×1/2=3、C为1
本题难度:简单