时间:2018-03-17 05:37:05
1、填空题 (8分)已知A~K均为中学化学中常见的物质,它们之间有如下图所示的转化关系,其中A为两种物质组成的混合物,H、I、K为单质,H是气体,G是红褐色沉淀。(反应过程中生成的水及其他产物没有列出)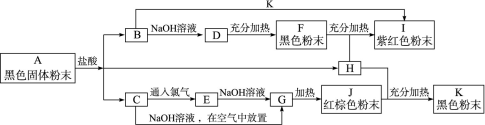
请回答以下问题:
(1)写出下列物质的化学式:H____________,J____________。
(2)写出A跟盐酸混合反应生成B的化学方程式:______________________。
(3)写出C跟氯气反应生成E的化学方程式:______________________。
参考答案:(1)H2 Fe2O3
(2)CuO+2HCl===CuCl2 +H2O
(3)2FeCl2 +Cl2 ===2FeCl3
本题解析:G是Fe(OH)3沉淀,所以C为FeCl2,E为FeCl3,J为Fe2O3。H是单质气体,能与Fe2O3在加热条件下反应生成的单质K显然是Fe,H应为H2。I为单质,且呈紫红色,I应为铜。黑色粉末F为CuO,D为Cu(OH)2,B为CuCl2。原黑色粉末应为CuO和铁粉的混合物。
本题难度:简单
2、填空题 利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下。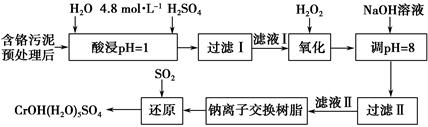
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4 mol·L-1的浓硫酸配制250 mL 4.8 mol·L-1的H2SO4溶液,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需_______________________ _。
(2)酸浸时,为了提高浸取率可采取的措施有_____________________________
______________________________________________________(答出两点)。
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72—,写出此反应的离子方程式:_____________________________________________________________。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | - | - | - |
| 沉淀完全时的pH | 3.7 | 11.1 | 8 | 9(>9溶解) |
参考答案:(1)250 mL容量瓶、胶头滴管
(2)升高反应温度、增大固体颗粒的表面积、加快搅拌速度等(答两点即可)
(3)2Cr3++3H2O2+H2O===Cr2O72—+8H+
(4)Na+、Mg2+、Ca2+ pH超过8会使部分Al(OH)3溶解生成AlO2—,最终影响Cr(Ⅲ)的回收与再利用
(5)Ca2+、Mg2+
(6)3SO2+2Na2CrO4+12H2O===2CrOH(H2O)5SO4↓+Na2SO4+2NaOH
本题解析:(1)结合一定物质的量浓度的溶液的配制步骤即可写出缺少的玻璃仪器,注意容量瓶必须注明规格。(4)加入NaOH溶液调节pH=8,Fe3+、Al3+以Fe(OH)3、Al(OH)3形式沉淀下来,溶液中还有Mg2+、Ca2+及加入的Na+。(5)运用钠离子交换树脂的目的是除去滤液Ⅱ中的Mg2+、Ca2+。
本题难度:困难
3、选择题 商品“纯净水”“太空水”“蒸馏水”等作为日常饮用水,因缺少某些成分而不利于儿童身体健康发育。你认为制备上述商品饮用水时,还需要添加的化学物质是( )。
A.钙、镁的碳酸氢盐
B.含碘酸钾的食盐
C.漂白粉、消毒剂
D.小苏打
参考答案:A
本题解析:此题体现了化学科学的实用性。水是日常生活中不可缺少的物质,水污染日益严重的今天,人们选择饮用的“纯净水”“太空水”“蒸馏水”中缺少人体必需的无机盐类,如Ca2+、Mg2+等。
本题难度:简单
4、填空题 (15分)水是生命之源,广西重金属镉污染事件是2012年1月15日发现的。水污染事件再次提醒人们保护水资源的必要性和紧迫性。工业废水中常含有一定量的Cr2O和CrO,它们会对人类及生态系统产生很大危害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法。
该法的工艺流程为: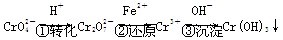
其中第①步存在平衡:
2CrO(黄色)+2H+ Cr2O(橙色)+H2O
Cr2O(橙色)+H2O
(1)若平衡体系的 pH = 2,该溶液显________色。
(2)能说明第①步反应达平衡状态的是________。(填序号)
A.Cr2O和CrO的浓度相同
B.2v(Cr2O)=v(CrO)
C.溶液的颜色不变
(3)第②步中,还原 1 mol Cr2O离子,需要______mol的FeSO4·7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)  Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至________。
方法2:电解法。
该法用 Fe 做电极电解含Cr2O的酸性废水,随着电解的进行,在阴极附近溶液 pH 升高,产生 Cr(OH)3沉淀。
(5)用Fe做电极的原因为__?__(用电极反应式解释)。
(6)在阴极附近溶液 pH 升高,溶液中同时生成的沉淀还有________。(用化学式表示)
(7)溶液中发生的总反应为(用离子方程式表示)?。
参考答案:(15分)除第(7)3分外,其余每空均为2分。
(1)橙 (2)C (3)6 (4)5
(5)阳极反应为 Fe-2e-===Fe2+
(6) Fe(OH)3
(7) 6Fe2++Cr2O72-+10OH-+7H2O=6Fe(OH)3↓+2Cr(OH)3↓(3分)
本题解析:方法1:还原沉淀法。
若平衡体系的 pH = 2,相当于在平衡中加入酸,平衡右移,显橙色。溶液的颜色不变说明第①步反应达平衡状态;第②步中,还原 1 mol Cr2O离子变为2molCr3+转移6mol电子,每摩尔亚铁离子转移1mol电子,需要6mol的FeSO4·7H2O。
Ksp=c(Cr3+)·c3(OH-)=10-32,要使c (Cr3+)降至10-5mol/L, c3(OH-)= 10-32/10-5=10-27
c(OH-)=10-9 mol/L,PH=5
方法2:电解法。
(5)用Fe做电极的原因为阳极反应为 Fe-2e-===Fe2+
(6) Cr2O还原Fe2+生成铁离子,与氢氧根生成Fe(OH)3。
(7)溶液中发生的总反应为6Fe2++Cr2O72-+10OH-+7H2O=6Fe(OH)3↓+2Cr(OH)3↓
本题难度:一般
5、选择题 2009年11月,国务院常务会议决定,到2020年我国单位国内生产总值二氧化碳排放比2005年下降40%一45%,作为约束性指标纳入国民经济和社会发展的中长期规划。将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
①6CO2+6H2O  C6H12O6+6O2
C6H12O6+6O2
②CO2+3H2 CH3OH+H2O
CH3OH+H2O
③CO2+CH4 ?CH3COOH
?CH3COOH
④2CO2+6H2 CH2=CH2+4H2O
CH2=CH2+4H2O
对以上反应的叙述,正确的是
A.最节能的是反应①
B.因为CH3OH有毒,故反应②无应用价值
C.反应③中的两种反应物都是可再生的天然物质
D.反应④是工业生产乙烯的一种主要方法
参考答案:A
本题解析:A:反应①可直接利用太阳能,正确
B:甲醇是重要的工业原料,有重要的应用价值,不正确
C:甲烷是不可再生的能源,不正确
D:乙烯的工业制法一般是石油裂化或采用发酵的方法来制取,不正确
答案为A
本题难度:一般