时间:2018-03-17 05:19:33
1、选择题 下列对各组物质性质的比较中,正确的是
A.第一电离能:Na<Mg<Al
B.熔点:金刚石>晶体硅>碳化硅
C.硬度:Li>Na>K
D.空间利用率:六方密堆<面心立方<体心立方
参考答案:C
本题解析:A选项,错误。同周期元素,从左到右,第一电离能逐渐增大趋势,但有些情况特殊,由于洪特规则中的充满与半充满状态下的电子更稳定,故第一电离能Mg>Al。B选项,错误。由共价键形成的原子晶体中,原子半径越小的,键长越短,键能越大,晶体的熔、沸点越高。如熔点:金刚石>碳化硅>晶体硅。C选项正确。D选项,错误。
本题难度:简单
2、选择题 水的状态除了气、液和固态外,还有玻璃态,它是由液态水急速冷却到165K时形成的,玻璃态的水无固定形状,不存在晶体结构,且密度与普通液态水的密度相同,则下列有关玻璃态水的叙述中正确的是
[? ]
A.玻璃态是水的一种特殊状态
B.水由液态变为玻璃态,体积膨胀
C.水由液态变为玻璃态,体积缩小
D.玻璃态的水是晶体
参考答案:A
本题解析:
本题难度:简单
3、选择题 某物质的晶体中含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子未能画出),晶体中A、B、C的中原子个数之比依次为(?)
A.1:3:1? B.2:3:1? C.2:2:1? D.1:3:3
参考答案:A
本题解析:根据均摊法可知,A原子的个数是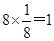 个,B原子个数是
个,B原子个数是 个,C原子个数是1个,所以晶体中A、B、C的中原子个数之比依次为1:3:1,答案选A。
个,C原子个数是1个,所以晶体中A、B、C的中原子个数之比依次为1:3:1,答案选A。
点评:该题是高考中的常见题型,属于基础性试题的考查。主要是考查学生灵活运用均摊法解决实际问题的能力,有利于调动学生的学习兴趣,激发学生的学习积极性,也有助于培养学生的逻辑推理能力。
本题难度:简单
4、选择题 已知CsCl晶体的密度为 ,NA为阿伏加德罗常数,相邻的两个
,NA为阿伏加德罗常数,相邻的两个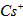 的核间距为a cm,如图所示,则CsCl的相对分子质量可以表示为
的核间距为a cm,如图所示,则CsCl的相对分子质量可以表示为
[? ]
A.
B.
C.
D.
参考答案:A
本题解析:
本题难度:一般
5、选择题 下列说法错误的是(? )
A.从CH4、NH4+、SO42-为正四面体结构,可推测PH4+、PO43-也为正四面体结构
B.1?mol金刚石晶体中,平均含有2?mol?C-C键
C.水的沸点比硫化氢的高,是因为H2O分子间存在氢键,H2S分子间不能形成氢键
D.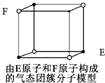 某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE
某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE
参考答案:D
本题解析:
本题难度:一般