时间:2018-03-17 05:18:42
1、选择题 下列每组中各物质内既有离子键又有共价键的一组是( )
A.NaOH、H2SO4、(NH4)2SO4
B.Mg(OH)2、Na2SO4、NH4HCO3
C.Na2O2、KOH、Na2SO4
D.HCl、Al2O3、MgCl2
参考答案:BC
本题解析:
本题难度:一般
2、填空题 (12分)
Ⅰ.顺铂是美国教授B Rosenberg等人于1969年发现的第一种具有抗癌活性的金属配合物,它的化学式为Pt(NH3)2Cl2。
(1)与NH3互为等电子体的分子、离子有?、?(各举一例)。
(2)碳铂是1,1-环丁二羧酸二氨合铂(Ⅱ)的简称,是第二代铂族抗癌药物,其他毒副作用低于顺铂。碳铂的结构如下图: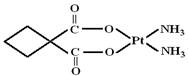
碳铂中含有的作用力有?(填字母)。
A.极性共价键
B.非极性共价键
C.配位键
D.离子键
E.金属键? F.σ键? G.π键
(3)碳铂中C原子的杂化方式有?。
(4)铂(Pt)单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。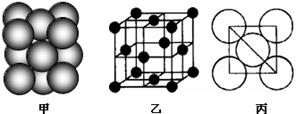
晶胞中铂(Pt)原子的配位数为?。
Ⅱ.原子序数小于36的元素A和B,在周期表中既处于同一周期又位于同一族,且原子序数B比A多1,基态B原子中含有三个未成对电子。请写出A2+在基态时外围电子(价电子)排布式为?, B元素在周期表中的位置为?。
参考答案:(1)PH3或AsH3、H3O+或CH3-?
(2)ABCFG?(3)sp3和sp2?(4)12?
Ⅱ? 3d6?第四周期Ⅷ族
本题解析:(1)1个NH3的电子数为10,核外电子总数为10个电子的微粒:
Ne、HF、H2O、NH3、CH4(分子类),
Na+、Mg2+、Al3+、NH4+、H3O+(阳离子类),
? N3-、O2-、F-、OH-、NH2-、CH3-(阴离子类)
(2)不同原子间形成极性共价键,如C-H、C-O、N-H;
相同原子间形成非极性共价键,如C-C;
Pt形成配位键;碳氧双键中一个是σ键,另一个是π键;
(3)左侧4碳环上的C原子采用sp3杂化,碳氧双键上的C原子采用sp2杂化;
(4)看乙图:若以上层中心的铂原子为中心,分别在上、下、同平面上的面对角线上共12个;
(5)“既处于同一周期(同一横行)又位于同一族,且原子序数B比A多1”,故两者只能是第四周期,VIII族的元素,“基态B原子中含有三个未成对电子”,则B的价电子排布为3d74S2,B为钴元素(第四周期Ⅷ族);则A为铁元素(价电子排布为3d64S2),则Fe2+(比铁原子失去最外层的两电子)在基态时价电子排布式为3d6;
本题难度:一般
3、选择题 下列关于晶体的说法正确的组合是
[? ]
①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、 H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑥晶体中分子间作用力越大,分子越稳定
⑦氯化钠熔化时离子键被破坏
A.①②③⑥
B.①②④
C.③④⑤
D.③⑤⑦
参考答案:D
本题解析:
本题难度:简单
4、选择题 下列物质属于离子化合物的是( )
A.O3
B.H2O
C.K2SO4
D.C2H5OH
参考答案:C
本题解析:
本题难度:简单
5、填空题 (4分)(1)下列7种物质:
①白磷(P4) ②水晶 ③氯化铵 ④氢氧化钙 ⑤氟化钠 ⑥过氧化钠 ⑦干冰
固态时都为晶体,其中既有范德华力,又有非极性键的晶体是
(填写序号,下同),只存在离子键的是 ,熔化时只破坏
共价键的是 。
(2)下图是XeF4的结构示意图,据此判断XeF4是 (填“极性”、“非极性”)分子。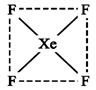
参考答案:(1)①⑤②(2)非极性(每空1分)
本题解析:(1)白磷形成的晶体是分子晶体,分子中含有范德华力与非极性键;水晶是二氧化硅,属于原子晶体,熔化破坏的是共价键;氯化铵、氢氧化钙、氟化钠、过氧化钠均是离子晶体,其中氯化铵、氢氧化钙、过氧化钠中既有离子键,又有共价键,而氟化钠中只有离子键;干冰是CO2形成的是分子晶体,含有极性键和范德华力。
(2)根据结构示意图可知,分子中正负电荷重心重合,属于非极性分子。
本题难度:一般