时间:2017-11-11 04:22:22
1、选择题 某原电池装置如图所示。下列有关叙述中,正确的是(? )
A.Fe作正极,发生氧化反应
B.负极反应:2H++2e-=H2↑
C.工作一段时间后,两烧杯中溶液pH均不变
D.工作一段时间后,NaCl溶液中c(Cl-)增大
参考答案:D
本题解析:A项,Fe作负极,发生氧化反应,不正确;B项,负极反应为:Fe-2e-=Fe2+,故不正确;C项,因为正极反应为:2H++2e-=H2↑,故右侧烧杯中溶液的pH增大,不正确;D项,因为在原电池盐桥中Cl-离子向负极移动,故NaCl溶液中c(Cl-)增大,正确。
本题难度:一般
2、选择题 观察下列几个装置示意图,有关叙述正确的是( )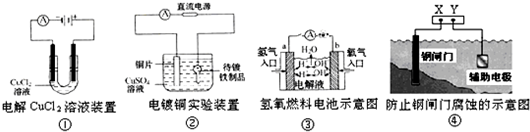
A.装置①中阳极上析出红色固体
B.装置②的待镀铁制品应与电源正极相连
C.装置③闭合电键后,外电路电子由a极流向b极
D.装置④的X电极是外接电源的正极
参考答案:A、装置①中阳极上是电解质中的氯离子失电子生成氯气的过程,故A错误;
B、在电镀池中,镀件金属应该做阴极,镀层金属做阳极,故B错误;
C、装置③闭合电键后,形成燃料电池,通氢气的极是负极,同氧气的极是正极,电子从负极流向正极,即由a极流向b极,故C正确;
D、装置④中,和电源正极X相连的电极铁是阳极,阳极铁易被氧化而腐蚀,达不到防腐蚀的目的,故D错误.
故选C.
本题解析:
本题难度:一般
3、填空题 (12分)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g) ⊿H
CH3OH(g) ⊿H
已知某些化学键的键能数据如下表:
| 化学键 | C—C | C—H | H—H | C—O | C≡O | H—O |
| 键能/kJ·mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |

参考答案:(12分) (1) -116 kJ·mol-1?(2) 0.0125 mol·L-1·min-1 , 4 , 减小
(3)AC? (4) 2 CH3OH-12e-+2H2O=2CO2+12H+
本题解析:(1)反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以根据反应式可知,该反应的△H=1072kJ·mol+2×436kJ·mol-3×412kJ·mol-358kJ·mol-463kJ·mol=-116kJ·mol.
(2)? CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
起始量(mol)? 1? 2? 0
转化量(mol)? x? 2x? x
平衡量(mol)? 1-x? 2-2x? x
所以有
解得x=0.5
CO表示的平均反应速率是 =0.0125 mol·L-1·min-1。该温度下平衡常数K=
=0.0125 mol·L-1·min-1。该温度下平衡常数K= ;正反应是放热反应,所以升高温度,平衡向逆反应方向进行,平衡常数减小。
;正反应是放热反应,所以升高温度,平衡向逆反应方向进行,平衡常数减小。
(3)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以A可以说明;B中反应速率的方向相反,但不满足速率之比是相应的化学计量数之比,不能说明;反应是体积减小的,所以压强也是减小的,C可以说明;D中反应速率的方向是相同的,速率之比是相应的化学计量数之比,因此D中的关系始终是成立,不正确,答案选AC。
(4)原电池中负极失去电子,所以甲醇在负极通入。由于质子交换膜只能允许氢离子通过,所以负极电极反应式是2 CH3OH-12e-+2H2O=2CO2+12H+。
本题难度:一般
4、填空题 (6分)Zn?MnO2干电池应用广泛,其电解质溶液是ZnCl2?NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或 负 )。
(2)若ZnCl2?NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是____________。
欲除去Cu2+,最好选用下列试剂中的________(填代号)。
A.NaOH
B.Zn
C.Fe
D.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是________________。若电解电路中通过2 mol电子,MnO2的理论产量为________g。
参考答案:(1)Zn(或锌) 正极 (2)锌与还原出的铜构成铜锌原电池而加快锌的腐蚀 B
(3)2H++2e-===H2↑ 87
本题解析:(1)在Zn?MnO2干电池中负极材料是Zn(或锌);正极材料是石墨。在电池工作时,电子由负极Zn流向正极C。(2)若ZnCl2?NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,是因为锌与还原出的铜构成铜锌原电池,Zn作负极,从而加快锌的腐蚀速率。欲除去Cu2+,但是又不与其中的其它物质发生反应,也不产生杂质,则应该加入Zn.因此选项为B。(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。在阴极由于阳离子的放电能力H+>Mn2+,所以阴极的电极反应式是2H++2e-===H2↑;若电解电路中通过2 mol电子,则根据质量守恒定律及电子守恒的规律可得1mol的MnO2,质量为87g.
本题难度:一般
5、简答题 现有A、B两种金属分别与盐酸反应,产生氢气的速率相近.请设计一个原电池实验证明A、B两种金属的活动性?(电极材料:A、B,电解质溶液:盐酸,其它实验用品可自选)
(画出简易装置图)
______
将A、B两种金属片用______连接放入盐酸中组成原电池,如A是较不活泼的金属,则A的现象是______,那么,B即是活泼的金属.
参考答案:电极材料为A、B,电解质溶液为盐酸,用导线将A、B两个电极相连形成的原电池如图为
,
若相比较A不活泼,作正极,发生还原反应,则A上发生2H++2e-═H2↑,可观察到有气泡逸出,
B较活泼,作负极,发生氧化反应,
故答案为:
;导线;有气泡逸出.
本题解析:
本题难度:一般