时间:2017-11-11 04:16:29
1、填空题 某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。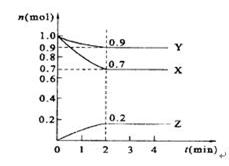
(1)图中所给数据进行分析,该反应的化学方程式为?。
(2)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=?。
(3)当反应进行到第?min,该反应达到平衡。
参考答案:(6分,每空2分)
(1)3X? +? Y?﹦ 2Z;
(2)0.05mol·(L·min)-1;
(3)2?。
本题解析:(1)由图可知随反应进行X、Y的物质的量变小,Z的物质的量变大,所以X、Y为反应物,z为生成物,反应结束各物质的物质的量不变,所以反应为可逆反应,X、Y、Z的化学计量数之比为(1-0.7)mol:(1-0.9)mol:0.2mol=3:1:2,所以反应方程式为3X+Y 2Z;
2Z;
(2)由图可知2min内Z的物质的量变化量为0.2mol,所以2min内以Z表示的平均反应速率v(Z)=0.2mol÷2L÷2min=0.05mol/(L?min),故B正确;
(3)由图可知,当时间为2min时,各个组份的物质的量不在发生变化,故反应进行第2min,该反应达到平衡。
点评:考查反应速率、方程式书写、化学平衡计算等,难度不大,关键是读懂图象运用所学知识解决问题。
本题难度:一般
2、填空题
(1)为了有效发展民用氢能源,首先必须制得廉价的氢气,下列可供开发又较经济且资源可持续利用的制氢气的方法是
A.电解水
B.锌和稀硫酸反应
C.光解海水
D.以石油、天然气为原料
(2)氢气燃烧时耗氧量小,发热量大。已知,热化学方程式为:
C(g)+O2(g)===CO2(g)? ΔH=-393.5 kJ·mol-1
H2(g)+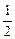 O2(g)===H2O(l)? ΔH=-285.8 kJ·mol-1
O2(g)===H2O(l)? ΔH=-285.8 kJ·mol-1
试通过计算说明等质量的氢气和碳燃烧时产生热量的比是___________。
(3)氢能源有可能实现能源的贮存,也有可能实现经济、高效的输送。研究表明过渡金属型氢化物(又称间充氢化物),在这类氢化物中,氢原子填充在金属的晶格间隙之间,其组成不固定,通常是非化学计量的,如:LaH2.76、TiH1.73、CeH2.69、ZrH1.98、PrH2.85、TaH0.78。已知标准状况下,1体积的钯粉大约可吸附896体积的氢气(钯粉的密度为10.64 g/cm3,相对原子质量为106.4),试写出钯(Pd)的氢化物的化学式___________。
参考答案:(1)C? (2)4.36∶1? (3)PdH0.8
本题解析:(1)光解水法:利用特殊催化剂,模拟生物光合作用制取氢气,是较经济且资源可持续利用的制氢方法。
(2)由热化学方程式可知,相同质量的氢气和碳完全燃烧时放出的热量之比:
(285.8 kJ·mol-1×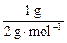 )∶(393.5 kJ·mol-1×
)∶(393.5 kJ·mol-1×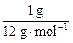 )=4.36∶1
)=4.36∶1
(3)由题意可知,1 cm3钯粉可吸收896 cm3的氢气,
Pd∶H=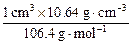 ∶
∶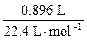 ×2=1∶0.8
×2=1∶0.8
故氢化物的化学式为PdH0.8
本题难度:简单
3、选择题 已知:①1?mol?H2分子中化学键断裂时需要吸收436?kJ的能量 ②1?mol?Cl2分子中化学键断裂时需要吸收243?kJ的能量 ③由H原子和Cl原子形成1?mol?HCl分子时释放431?kJ的能量下列叙述正确的是
[? ]
A.氢气和氯气反应生成氯化氢气体的热化学方程式是 H2(g)+Cl2(g)===2HCl(g)
B.氢气和氯气反应生成2?mol氯化氢气体,反应的 ΔH=183?kJ mol-1
mol-1
C.氢气和氯气反应生成2?mol氯化氢气体,反应的 ΔH=-183?kJ mol-1
mol-1
D.氢气和氯气反应生成1?mol氯化氢气体,反应的 ΔH=-183?kJ mol-1
mol-1
参考答案:C
本题解析:
本题难度:一般
4、选择题 下列关于化学键的说法中正确的是
A.构成单质分子的微粒一定含有共价键
B.由非金属组成的化合物不一定是共价化合物
C.非极性键只存在于双原子单质分子里
D.不同元素组成的多原子分子里的化学键一定是极性键
参考答案:B
本题解析:A、构成稀有气体单质分子的微粒中不含有共价键,故A错误;
B、铵盐是离子化合物,组成元素是非金属元素,所以由非金属元素组成的化合物不一定是共价化合物,故B正确;
C、非极性键是相同元素的原子间形成的共价键,可以是单质,也可以存在于化合物,如过氧化钠中,过氧化氢中,故C错误;
D、不同元素组成的多原子分子里的化学键可以是极性共价键,也可以是非极性共价键如过氧化氢中,故D错误。
故选B。
点评:本题考查了稀有气体结构、铵盐结构、非极性共价键的含义、化学键的存在形式,选项BD为解答中的易错点,难度不大。
本题难度:简单
5、简答题 有下列六种固体物质:①氯化镁、②金刚石、③白磷、④过氧化钠、⑤干冰、⑥二氧化硅,请回答有关这六种固体物质的问题.
(1)将这六种固体按不同晶体类型分成三组,并填写下表:
| 晶体类型 | 离子晶体 | 原子晶体 | 分子晶体 各组中物质的编号 |
参考答案:(1)①氯化镁由阴阳离子构成,是离子晶体;
②金刚石由原子构成,是原子晶体;
③白磷由分子构成,是分子晶体;
④过氧化钠由阴阳离子构成,是离子晶体;
⑤干冰由分子构成,是分子晶体;
⑥二氧化硅由原子构成,是原子晶体;
故答案为:①④、②⑥、③⑤;?
(2)以共价键相结合,原子彼此间形成空间网状结构的是金刚石和二氧化硅,金刚石是单质,二氧化硅是化合物;
分子晶体内存在分子,白磷是单质,干冰是化合物;
过氧化钠晶体中过氧根离子和钠离子之间的化学键是离子键,氧原子和氧原子之间的化学键是非极性共价键,所以过氧化钠中存在离子键和共价键.
故答案为:⑥;③;④.
(3)原子晶体硬度大,金刚石的硬度最大;分子晶体的熔点较低,但标况下白磷是固体,二氧化碳是气体,所以干冰的熔点低.
故答案为②;⑤.?
(4)氯化镁阴阳离子间的作用力是离子键,所以氯化镁的电子式为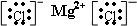
;干冰中原子间的作用力是极性共价键,所以干冰的结构式为O=C=O,
故答案为: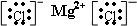
;O=C=O,
本题解析:
本题难度:一般