时间:2017-11-11 04:11:46
1、选择题 下列实验事实中,能用键能大小来解释的是( )
①稀有气体一般较难发生化学反应 ?
②金刚石比晶体硅的熔点高
③氮气比氯气的化学性质稳定 ?
④通常情况下,溴是液态,碘是固态.
A.①②
B.②③
C.①④
D.①②③④
参考答案:B
本题解析:
本题难度:简单
2、选择题 下列物质中,所含的原子或离子中最外层都为8电子结构的是
[? ]
A.HCl
B.Na2S
C.LiCl
D.H2O
参考答案:B
本题解析:
本题难度:简单
3、选择题 A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,辛是由C元素形成的单质.已知:甲+乙=丁+辛,甲+丙=戊+辛;常温下0.1mol/L丁溶液的pH为13.下列说法正确的是( )
A.元素B在周期表中的位置为第二周期第VIA族
B.元素B、C、D的原子半径由大到小的顺序为r(D)>r(C)>r(B)
C.1.0L0.1mol/L戊溶液中阴离子总的物质的量小于0.1mol
D.1mol甲与足量的乙完全反应共转移了约6.02×1O23个电子
参考答案:0.1 mol/L 丁溶液的pH为13(25℃),丁是一元强碱,其含有的金属元素在短周期,则丁应为NaOH,发生反应:甲+乙=丁+辛,根据元素守恒可知,甲、乙两种物质至少共含有H、O、Na元素,辛是由C组成的单质,由发生反应可知,辛不能是Na,结合原子数可知,A为H、C为O、D为Na元素,故辛为氧气,可知甲是Na2O2、乙是水,再根据反应:甲+丙=戊+辛,可知丙是二氧化碳,戊是碳酸钠,则B为碳元素,
A.Y为碳,在周期表中的位置为:第二周期第ⅣA族,故A错误;
B.同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大,故原子半径大小顺序为:Na>C>O,即:D>B>C,故B错误;
C.戊是碳酸钠,在碳酸钠溶液中,CO32-离子水解生成HCO3-离子和OH-离子,溶液中阴离子总的物质的量大于0.1mol,故C错误;
D.甲与足量的乙完全反应的方程式为:2Na2O2+2H2O═4NaOH+O2↑,1molNa2O2反应转移的电子为1mol,约6.02×1O23个电子,故D正确,
故选D.
本题解析:
本题难度:简单
4、填空题 化学中的某些元素是与生命活动密不可分的元素。请回答下列问题:
(1)NH4NO3是一种重要的化学肥料,其中N原子的杂化方式分别是________,NO3—的空间构型为____________。
(2)A、B、C三元素的原子序数依次增大,它们原子的最外层电子排布均为4s1。
①B元素基态原子电子排布式为___________________________________________。
②A元素单质的晶体堆积模型为________(填字母),其空间利用率为__________。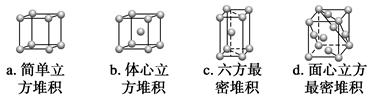
③氢元素与C元素可形成一种红色化合物,其晶体结构单元如下图。则该化合物的化学式为__________(小白球表示H,小黑球表示C)。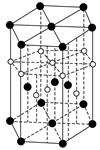
(3)已知氮化硼(BN)的一种晶体结构与金刚石相似,则B—N—B之间的夹角是________,氮化硼的密度为3.52 g·cm-3,则B—N键的键长是________pm(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
参考答案:(1)sp3、sp2杂化 平面三角形
(2)①1s22s22p63s23p63d54s1或[Ar]3d54s1
②b 68%
③CuH
(3)109°28′ 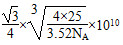
本题解析:(1)NH4+为正四面体结构,所以N原子的杂化方式为sp3,NO3—中含有3对价层电子对,其离子构型为平面三角形,N原子采取sp2杂化。
(2)A、B、C的价电子构型分别为4s1、3d54s1、3d104s1,所以A为K,B为Cr,C为Cu。K为体心立方堆积,Cu为面心立方最密堆积,体心立方堆积的空间利用率为68%,而面心立方最密堆积的空间利用率为74%。
③H( )∶6×
)∶6× +1+3=6
+1+3=6
Cu( )∶12×
)∶12×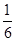 +2×
+2×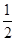 +3=6
+3=6
其化学式为CuH。
(3)BN的基本结构单元为正四面体,所以B—N—B之间的夹角为109°28′。一个金刚石晶胞中含有C原子数为8×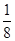 +6×
+6×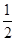 +4=8个,所以一个BN晶胞中含有4个B原子,4个N原子,设晶胞的棱长为a cm,则B—N的键长为
+4=8个,所以一个BN晶胞中含有4个B原子,4个N原子,设晶胞的棱长为a cm,则B—N的键长为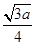 ?(为体对角线的
?(为体对角线的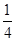 )。
)。
a3·3.52×NA=4×25
a=
所以其键长为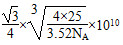 pm。
pm。
本题难度:一般
5、填空题 溴化碘的化学性质类似于卤素单质,试回答: ?
(1)溴化碘的电子式是____,它是由____(填“极性”或“非极性”)键形成的分子。?
(2)溴化碘可以与镁反应生成溴化镁与碘化镁,该反应中氧化产物是_____________,还原产物是______________。 ?
(3)溴化碘可以与水反应(同Cl2与水的反应相似),写出该反应的化学方程式________________________,其中生成的含氧化合物的电子式为________________。
参考答案:(1)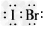 ;极性?
;极性?
(2)MgBr2和MgI2;MgI2?
(3)IBr+ H2O=HIO+HBr;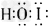
本题解析:
本题难度:一般