时间:2017-11-11 04:04:07
1、选择题 下列实验操作中正确的是
[? ]
A.?蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热?
B.?蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C.?萃取操作时,选择的萃取剂的密度必须比水大?
D.?蒸馏操作时,冷水从上口入,下口出
参考答案:B
本题解析:
本题难度:简单
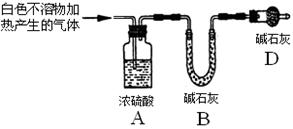
2、实验题 资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。某同学设计了如下实验方案并验证产物、探究反应原理。
(1)提出假设
实验I:用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红。
该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为?。
猜测2:白色不溶物可能为MgCO3。
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3·yMg(OH)2]。
(2)设计定性实验确定产物并验证猜测:
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅱ | 将实验I中收集到的气体点燃 | 能安静燃烧、产生淡蓝色火焰 | 气体成分为___?___? |
| 实验Ⅲ | 取实验I中的白色不溶物,洗涤,加入足量 ??? | ? ??? | 白色不溶物可能含有MgCO3 |
| 实验Ⅳ | 取实验I中的澄清液,向其中加入少量CaCl2稀溶液 | 产生白色沉淀 | 溶液中存在?④?离子 |
参考答案:(共9分)
(1)猜测1:Mg(OH)2(1分)
(2)①氢气 ;②稀盐酸(合理均可);?
③产生气泡,沉淀全部溶解 ;④CO2- 3(各1分)
(3) 2MgCO3·Mg(OH)2?或 Mg(OH)2·2MgCO3?或? Mg3(OH)2(CO3)2?
(4)NaHCO3溶液中存在如下平衡:HCO- 3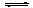 H+ +CO2- 3、H2O
H+ +CO2- 3、H2O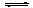 H++OH-;Mg和H+反应生成H2和Mg2+,Mg2+跟OH-、CO32-生成难溶物Mg(OH)2·2MgCO3,则H+、OH-、CO2- 3的浓度均降低,促使上述两平衡均向右移动。故Mg和饱和NaHCO3溶液反应产生大量气体H2。
H++OH-;Mg和H+反应生成H2和Mg2+,Mg2+跟OH-、CO32-生成难溶物Mg(OH)2·2MgCO3,则H+、OH-、CO2- 3的浓度均降低,促使上述两平衡均向右移动。故Mg和饱和NaHCO3溶液反应产生大量气体H2。
本题解析:
(1)由题可知猜测为Mg(OH)2
(2)①镁与水反应生成氢气。②检测碳酸盐一般加入盐酸。③看是否有二氧化碳生成。④溶液中有CO32-与Ca2+生成白色沉淀。
(3)根据题意可得关系式Mg(OH)2~H2O,MgCO3~CO2,n(H2O)=1.8g/18g/mol=0.1mol,n(CO2)=8.8g/44g/mol=0.2mol,可知为2MgCO3·Mg(OH)2?或 Mg(OH)2·2MgCO3?或Mg3(OH)2(CO3)2?。
(4)NaHCO3溶液中存在如下平衡:HCO- 3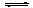 H+ +CO2- 3、H2O
H+ +CO2- 3、H2O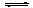 H++OH-;Mg和H+反应生成H2和Mg2+,Mg2+跟OH-、CO32-生成难溶物Mg(OH)2·2MgCO3,则H+、OH-、CO2- 3的浓度均降低,促使上述两平衡均向右移动。故Mg和饱和NaHCO3溶液反应产生大量气体H2。
H++OH-;Mg和H+反应生成H2和Mg2+,Mg2+跟OH-、CO32-生成难溶物Mg(OH)2·2MgCO3,则H+、OH-、CO2- 3的浓度均降低,促使上述两平衡均向右移动。故Mg和饱和NaHCO3溶液反应产生大量气体H2。
本题难度:困难
3、选择题 下列各组混合物不能用分液漏斗分离的是
[? ]
A.硝基苯和水
B.苯和甲苯
C.溴苯和NaOH溶液
D.甘油和水
参考答案:BD
本题解析:
本题难度:简单
4、选择题 在标准状况下,1.6L氮气中含m个分子,则阿伏加德罗常数为
A.14m
B.28m
C.
D.7m
参考 答案:A
本题解析:分析:根据n= =
= 计算.
计算.
解答:n(N2)= =
= ,
,
则NA= =
= =14m,
=14m,
故选A.
点评:本题考查阿伏加德罗常数的计算,题目难度不大,注意有关计算公式的运用.
本题难度:困难
5、填空题 (8分)
在下表中填入除去各粉末状混合物中的杂质(括号内为杂质)所用的试剂。将所选试剂的代号填入表内“试剂”栏相应的空格内。
可供选择的试剂:
A.盐酸,
B.氢氧化钠溶液,
C.氧气,
D.水,E.二氧化碳
参考答案:(1)B(2分)?(2)A(2分)?(3)D(2分)?(4)A(2分)
本题解析:
(1) 氢氧化钠与二氧化硅发生反应:SiO2+2NaOH ="=" Na2SiO3+H2O,氢氧化钠与碳酸钙不反应,反应后过滤、洗涤、干燥后即可分离。故氢氧化钠可除去碳酸钙中的二氧化硅杂质。
(2) 盐酸和碳酸钙发生反应:CaCO3+2HCl=CaCl2+CO2↑+H2O,盐酸和二氧化硅不反应,反应后过滤、洗涤、干燥后即可分离。故盐酸可除去二氧化硅中的碳酸钙杂质。
(3)氯化钠溶于水,二氧化硅不能。故可用水溶解混合物,过滤,把滤液进行蒸发结晶即可。故水可分离氯化钠和二氧化硅的混合物。
(4)盐酸和氧化铁发生反应:6HCl+2Fe2O3==2FeCl3+3H2O,盐酸和二氧化硅不反应,反应后过滤、洗涤、干燥后即可分离。故盐酸可除去二氧化硅中的氧化铁。
本题难度:一般