时间:2017-11-11 04:01:50
1、选择题 A,B两种元素的原子,当它们都获得2个电子形成稳定结构的阴离子时,A放出的能量大于B,由此可知:
A.稳定性:H2A>H2B
B.还原性:A2->B2-
C.原子半径:A>B
D.非金属性:A
参考答案:A
本题解析:
本题难度:简单
2、选择题 下列物质的转化在给定条件下不能实现的是
A.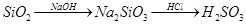
B.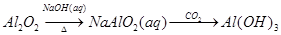
C.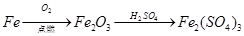
D.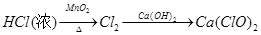
参考答案:C
本题解析:C、铁在氧气中燃烧生成的是Fe3O4, 而不是Fe2O3,C错误。
本题难度:一般
3、选择题 下列各组性质比较中,正确的是( )
①酸性:HClO4>HBrO4>HIO4?②碱性:Ba(OH)2>Mg(OH)2>Be(OH)2
③氧化性:F>C>O?④氧化性:Li+﹤Na+﹤K+
⑤气态氢化物稳定性:HF>HCl>H2S
A.①②③
B.②③④
C.①②⑤
D.①②④⑤
参考答案:C
本题解析:试题分析:元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;元素的金属性越强,对应的最高价氧化物的水化物的碱性越强;元素的非金属性越强,对应的氢化物越稳定;元素的非金属性越强,对应离子的还原性越弱。
③氧化性的研究对象不是元素,故错;④氧化性顺序为Li+>Na+>K+,故错。故选C。
考点:非金属在元素周期表中的位置及其性质递变的规律 金属在元素周期表中的位置及其性质递变的规律
点评:本题考查元素周期律的递变,题目难度不大,本题注意把握元素周期律的递变规律以及金属性、非金属性与最高价含氧酸、碱以及氢化物稳定性的关系。
本题难度:简单
4、选择题 对下列实验现象的解释正确的是
| 选项 | 实验现象 | 解释 |
| A | Cl2使鲜艳的红色花瓣褪色 | Cl2具有漂白性 |
| B | NH3与HCl气体接触时有白烟产生 | NH3与HCl反应生成NH4C1固体小颗粒 |
| C | 冷浓硝酸可以用铝罐贮存 | 浓硝酸使金属铝发生钝化 |
| D | SO2使氢氧化钠的酚酞溶液褪色 | SO2具有酸性 |
参考答案:BC
本题解析:略
本题难度:简单
5、填空题 X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻。X的核电荷数是Y的核外电子数的一半,Y与M可形成化合物M2Y。用微粒符号完成下列问题:
(1)Y、Z两种元素的最高价氧化物的水化物酸性___________强于___________。
(2)M、Z、Y形成的简单离子的半径的大小________________。
(3)M2X2固体中阴、阳离子个数比____________,其电子式为_______________。该物质中含有化学键的类型有______________和______________。
(4)将Z的单质通入YX2的水溶液中发生反应的离子方程式为___________________。
参考答案:(1)HClO4;H2SO4
(2)S2->Cl-> K+
(3)1:2;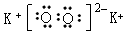 ;离子键;非极性共价键
;离子键;非极性共价键
(4)Cl2+SO2+2H2O==4H++2Cl-+SO42-
本题解析:
本题难度:一般