时间:2017-11-11 04:01:25
1、简答题 【物质结构与性质】
(1)甲、乙两种元素是同一周期的相邻元素,甲元素是形成有机物的主要元素,乙元素的p亚层上有3个电子.
①写出甲元素的电子排布式______,下列各化合物分子中甲元素的原子杂化方式全部相同的是______(填序号).
a.H2C=CH-C≡CH
b.CH2=C(CH3)-CH2-CH3
c.C(CH2OH)4
d.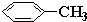
e.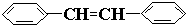
f.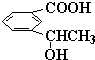
②甲、乙元素可形成硬度大于金刚石的一种化合物,该化合物属于______晶体,其化学式为______.
(2)人们一直致力于人工固氮的研究以获得廉价的氮肥.科学家先后提出并合成得到固氮酶的多种模拟物.其中一类是含Mo、Fe、S原子的类立方体结构,如图所示.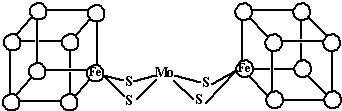
图中左右两边对称,各含一个近似为立方体的结构.每个立方体含有4个Fe原子、4个S原子,它们位于立方体的8个顶点,且原子间只有一种化学键.上述一个立方体中4个Fe原子所在的顶点连接所构成的空间几何体为______.
参考答案:(1)甲、乙两种元素是同一周期的相邻元素,甲元素是形成有机物的主要元素,则甲是C元素,乙元素的p亚层上有3个电子,则乙是N元素.
①甲是C元素,其原子核外有6个电子,根据构造原理知其基态原子核外电子排布式为1s22s22p2;
a.H2C=CH-C≡CH中形成碳碳双键的碳原子含有3个σ键且不含孤电子对,所以采用sp2杂化,形成碳碳三键的碳原子含有2个σ键且不含孤电子对,所以采用sp杂化,故错误;
b.CH2=C(CH3)-CH2-CH3中甲基和亚甲基上的碳原子含有4个σ键且不含孤电子对,所以采用sp3杂化,形成碳碳双键的碳原子含有3个σ键且不含孤电子对,所以采用sp2杂化,故错误;
c.C(CH2OH)4中所有碳原子都含有4个σ键且不含孤电子对,所以采用sp3杂化,故正确;
d. 中甲基上的碳原子含有4个σ键且不含孤电子对,所以采用sp3杂化,苯环上的碳原子含有
中甲基上的碳原子含有4个σ键且不含孤电子对,所以采用sp3杂化,苯环上的碳原子含有
3个σ键且不含孤电子对,所以采用sp2杂化,故错误;
e.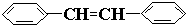 中苯环上的碳原子、形成碳碳双键的碳原子都含有3个σ键且不含孤电子对,所以采用sp2杂化,故正确;
中苯环上的碳原子、形成碳碳双键的碳原子都含有3个σ键且不含孤电子对,所以采用sp2杂化,故正确;
f.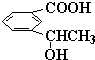 中苯环上的碳原子含有3个σ键且不含孤电子对,所以采用sp2杂化,甲基上碳原子含有4个σ键且不含孤电子对,所以采用sp3杂化,故错误;
中苯环上的碳原子含有3个σ键且不含孤电子对,所以采用sp2杂化,甲基上碳原子含有4个σ键且不含孤电子对,所以采用sp3杂化,故错误;
故选ce;
故答案为:1s22s22p2;ce;
②原子晶体的硬度较大,碳和氮形成的化合物硬度较大,所以属于原子晶体,碳元素的非金属性小于氮元素,所以碳显正价,氮元素显负价,在该化合物中,碳元素显+4价,N元素显-3价,所以其化学式为C3N4,
故答案为:原子晶体;C3N4;
(2)由信息可知,小正方体中4个铁原子应在互不相邻的顶点上,且这四个顶点连接构成正四面体,
故答案为:正四面体.
本题解析:
本题难度:一般
2、简答题 现有部分短周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 X 最外层电子数是次外层电子数的3倍 Y 常温下单质为双原子分子,其氢化物水溶液呈碱性 Z 第三周期元素的简单离子中半径最小 |
参考答案:短周期元素中,最外层电子数是次外层电子数的3倍,即第一层电子数为2,第二层电子数为6,则X为氧元素;常温下单质为双原子分子,其氢化物水溶液呈碱性,即氢化物为氨气,则Y为氮元素;第三周期元素的简单离子中半径最小,阴离子的半径大于阳离子的半径,金属离子中原子序数越大的半径最小,则Z为铝元素;
(1)因氧元素的单质臭氧具有强氧化性,则可在生活中常用作饮水机的消毒剂,铝离子的质子数为13,核外电子数为10,其结构示意图为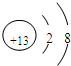
,
故答案为:O3;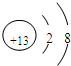
;
(2)因铵根离子能与碱反应生成氨气,且氨气能使湿润的红色石蕊试纸变蓝,故答案为:取少量溶液(或待测液)于试管中,滴加适量浓NaOH溶液后加热,将湿润的红色石蕊试纸沾在玻璃棒上靠近试管口部,若试纸变蓝,说明溶液中存在该离子,反之,不存在该离子;
(3)Z元素最高价氧化物对应的水化物,Al(OH)3与NaOH的反应为Al(OH)3+NaOH=NaAlO2+2H2O,离子反应为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;?
(4)因N、O元素处于同周期,同周期随原子序数的增大,非金属在增强,故O元素的非金属强,a中的氧化还原反应可判断氧气的氧化性大于氮气的氧化性,则氧的非金属性大于氮元素的非金属性,b中与氢气的化合的难易程度可知氧的非金属性强,c中氧比氮元素容易得到电子,则氧的非金属强,故答案为:O;a,b,c.
本题解析:
本题难度:一般
3、填空题 短周期元素T、Q、R、W、Z在元素周期表中的位置如图1所示,其中T所处的周期序数与主族序数相等,请回答下列问题: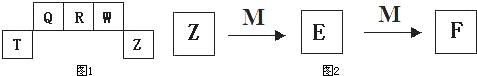
(1)Q的气态氢化物的分子式为______.其分子的空间结构为______结构.
(2)Z元素比R元素的非金属性强.能证明这一结论的事实是______(填序号).
①相同条件下,Z单质在水中的溶解性强于R单质
②Z单质与氢气化合比R单质与氢气化合容易
③Z的氢化物比R的氢化物稳定
(3)向T、Z元素形成的化合物的溶液中逐滴加入NaOH溶液,先产生白色沉淀;继续滴加NaOH溶液,直至沉淀溶解.写出沉淀溶解的反应离子方程式:______.
(4)QW和RW都是汽车尾气中含有的大气污染物,它们在汽车排气管的“催化转换器”中反应生成可参与大气生态循环的无毒气体,化学方程式为______.
(5)M是一种常见的金属单质,与元素Z的单质有如图2所示转化关系,则E转化为F的反应的离子方程式是______.
把一定量的M放入E溶液中,完全反应后,所得溶液中E、F的物质的量相等,则已反应的E与未反应的E的物质的量之比为______.
参考答案:短周期元素T、Q、R、W、Z在元素周期表中的位置如图1所示,其中T所处的周期序数与主族序数相等,则T应为第三周期第ⅢA族元素,为Al,则Q为C,R为N,W为O,Z为Cl,
(1)Q的气态氢化物为甲烷,其分子式为CH4,空间结构为正四面体,故答案为:CH4;正四面体;
(2)①相同条件下,Z单质在水中的溶解性强于R单质,不能利用溶解性比较非金属性,故不选;
②Z单质与氢气化合比R单质与氢气化合容易,则Z活泼,Z元素比R元素的非金属性强,故选;
③Z的氢化物比R的氢化物稳定,则Z元素比R元素的非金属性强,故选;
故答案为:②③;
(3)氯化铝与NaOH反应生成氢盐化铝沉淀,继续加NaOH沉淀溶解的离子反应为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)由信息可知,CO和NO反应生成氮气和二氧化碳,其化学反应为2CO+2NO催化剂.2CO2+N2,故答案为:2CO+2NO催化剂.2CO2+N2;
(5)由转化关系可知,M为变价金属,则为Fe,所以E为FeCl3,F为FeCl2,E转化为F的反应的离子方程式是2Fe3++Fe=3Fe2+,溶液中E、F的物质的量相等,设生成F为3mol,由反应方程式可知反应的E为2mol,剩余的E为mol,所以已反应的E与未反应的E的物质的量之比为2:3,故答案为:2Fe3++Fe=3Fe2+;2:3.
本题解析:
本题难度:一般
4、选择题 以下说法正确的是?
A.白磷与金刚石一样,晶体中原子以共价键结合,形成空间网状结构
B.CO2和SiO2晶体中,化学键类型相同,晶体类型也相同
C.共价化合物可以含离子键
D.NH4Cl晶体中既含有离子键又含有共价键
参考答案:D
本题解析:A不正确,白磷是分子晶体,金刚石是原子晶体。B不正确,CO2是分子晶体。全部由共价键形成的化合物是共价化合物,所以共价化合物中不能含有离子键,C不正确。答案选D。
本题难度:简单
5、选择题 下列有关化学用语或名称表达正确的是
[? ]
A.亚硫酸的电离方程式:H2SO3==2H++SO32-
B.乙炔的分子结构模型示意图: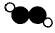
C.H2O2的电子式: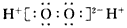
D. 的名称:3-甲基-1-丁醇
的名称:3-甲基-1-丁醇
参考答案:D
本题解析:
本题难度:简单