时间:2017-11-11 03:58:17
1、实验题 某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有_______________________;
(2)硫酸铜溶液可以加快氢气生学成速率的原因是___________________;
(3)实验室中现有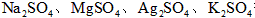 等4中溶液,可与实验中
等4中溶液,可与实验中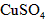 溶液起相似作用的是___________________;
溶液起相似作用的是___________________;
(4)要加快上述实验中气体产生的速率,还可采取的措施有___________________(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。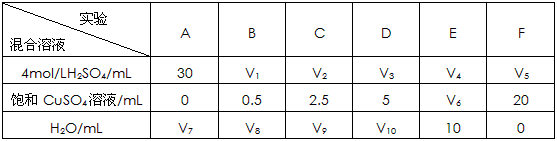
①请完成此实验设计,其中:V1=__________,V6=____________,V9=_____________;
②该同学最后得出的结论为:当加入少量溶液时,生成氢气的速率会大大提高。但当加入的溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因_______________________。
参考答案:(1)Zn+CuSO4==ZnSO4+Cu,Zn+H2SO4==ZnSO4+H2↑
(2)CuSO4与Zn反应产生的Cu与Zn形成铜锌原电池,加快了氢气产生的速率
(3)Ag2SO4
(4)升高反应温度、适当增加硫酸的浓度(答案合理即可)
(5)①30;10;17.5
②当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积
本题解析:
本题难度:困难
2、实验题 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下"Fe与水蒸气反应的实验"。 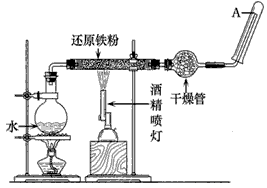
请回答该实验中的问题。
(1)写出该反应的化学方程式? 。
(2)实验前必须对整套装置进行的操作是? 。
(3)圆底烧瓶中盛装的是水,该装置受热后的主要作用是? 。
(4)干燥管中盛装的物质可以是? ?,作用是? 。
(5)试管中收集到的气体是? ? ,如果要在A处玻璃管口处点燃该气体,则必须对该气体进行? ,这一操作的目的是? 。
参考答案:(1)3Fe+4H2O(g) Fe3O4+4H2
Fe3O4+4H2
(2)检验装置的气密性
(3)为(硬质玻璃管内Fe与水蒸气的反应)实验提供(持续不断的)水蒸气
(4)碱石灰(或其它固体干燥剂);干燥反应产生的H2
(5)H2;验纯;防止点燃时,氢气因含有氧气而爆炸
本题解析:
本题难度:一般
3、实验题 (14分)实验室需要0.80 mol/L NaOH溶液475 mL和0.40 mol/L硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是___________(填序号),配制上述溶液还需用到的玻璃仪器是________________________(填仪器名称)。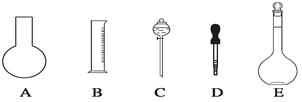
(2)根据计算用托盘天平称取NaOH的质量为_______g;根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为______mL。
(3)下图是某同学转移溶液的示意图,图中的存在的错误是_______________________。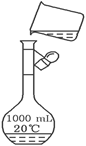
(4)在实验中其他 操作均正确,若定容时俯视视刻度线,则所得溶液浓度_____0.8 mol/L(填“>、<或=”,下同)。若定容时,有少许蒸馏水洒落在容量瓶外,则所得溶液浓度_____0.8 mol/L。
操作均正确,若定容时俯视视刻度线,则所得溶液浓度_____0.8 mol/L(填“>、<或=”,下同)。若定容时,有少许蒸馏水洒落在容量瓶外,则所得溶液浓度_____0.8 mol/L。
参考答案:(14分)
(1)A、C;烧杯、玻璃棒
(2)16.0;10.9
(3)
(4)>、=
本题解析:略
本题难度:一般
4、实验题 某研究性学习小组对过量炭粉与氧化铁(Fe2O3)反应的气体产物成分进行研究。
(1)提出假设 ①气体产物是CO2。?②气体产物是CO。?③气体产物是__________。
(2)设计方案? 如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。 
(3)查阅资料氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气,该反应的离子方程式:_______________。
(4)实验步骤
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g; ?
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g。
步骤②、④中都分别通入N2,其作用分别为_____________。
(5)数据处理试根据实验数据分析判断,前面的假设_________(填①、②、③)是正确的。写出该实验中氧化铁与碳发生反应的化学方程式:______________________。
参考答案:(1)CO2、CO的混合物?
(3)NH4++NO2- N2↑+2H2O
N2↑+2H2O
(4)步骤②中是为了排尽空气、步骤④是为了赶出所有的CO2,确保完全吸收 ?
(5)③;2C+Fe2O3 2Fe+CO↑+CO2↑
2Fe+CO↑+CO2↑
本题解析:
本题难度:一般
5、实验题 实验:探究钠、镁、铝的金属性强弱。?
?仅限选择的仪器和试剂:烧杯、试管、试管夹、酒精灯、滴管、药匙、火柴;Na、Mg、Al、水、稀盐酸、NaOH溶液、酚酞试液?
完成以下实验探究过程:?
(1)提出假设:三种金属的活泼性由强到弱的顺序为Na>Mg>Al?
(2)设计实验方案?
(3)实验过程?
? 根据(2)的实验方案,叙述实验操作、预期现象和结论。
参考答案:②钠激烈反应,溶液变红,产生大量气体,镁没有明显现象?,说明钠的金属性比镁强;
③将少许镁和铝分别加入盛有适量稀盐酸试管中?;
本题解析:
本题难度:一般