时间:2017-11-11 03:50:38
1、选择题 下列说法正确的是
①CH3COONa、BaSO4都是强电解质;?②中和滴定过程中,应注视锥形瓶内溶液颜色的变化,以准确把握滴定终点;?③测定溶液的PH值时,用玻璃棒蘸取少量溶液点在湿润的pH试纸上再与标准比色卡对照;?④ 0.1 mol·L-1 NaOH溶液与0.1 mol·L-1 Ba(OH)2溶液的PH相同;?⑤日用铝制品表面覆盖着氧化膜,对内部金属起保护作用。
A.①②④
B.①②⑤
C.②③⑤
D.③④⑤
参考答案:B
本题解析:①正确,强电解质是指在水溶液中或熔融状态下全部电离的电解质。CH3COONa溶于水且全部电离,BaSO4虽难溶于水,但溶于水的那部分是全部电离的,属于强电解质;
②正确,中和滴定过程中操作方法:左手控制活塞,右手振荡锥形瓶,两只眼睛注视锥形瓶内溶液颜色的变化;③错,测定溶液的PH值时,不能将pH试纸润湿,会稀释溶液导致PH值可能会发生变化;④错,0.1 mol·L-1 NaOH溶液与0.1 mol·L-1 Ba(OH)2溶液中氢氧根离子的浓度不同,氢氧化钡溶液中氢氧根离子的浓度是氢氧化钠溶液的2倍,PH不相同;⑤正确,铝露置于空气中表面会形成一致密而薄的氧化物保护膜。
本题难度:一般
2、选择题 常温下,有关①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液,四种溶液的比较中,正确的是
A.水电离的c(H+):①=②=③=④
B.将②、③溶液混合后pH=7,则消耗溶液的体积:②=③
C.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大
D.向溶液中加入100mL水后,溶液的pH:③>④>①>②
参考答案:A
本题解析:A、①、②的氢离子浓度相同,③、④的氢氧根离子的浓度相同,无论酸还是碱都抑制水的电离,且相同氢离子浓度或氢氧根离子浓度对水的抑制程度相同,所以这四种溶液中由水电离的c(H+):①=②=③=④,故A正确;B、盐酸中的c(H+)与氨水中的c(OH–)相等(均为0.01 mol·L–1),当等体积混合时,由于大部分的氨水没有反应而使混合溶液显碱性,pH>7,故B错误;C、CH3COOH是弱酸,HCl和NaOH是强电解质,①、②、④三种溶液的物质的量浓度关系为:①>②=④,所以等体积的①、②、④溶液分别与铝粉反应,生成H2的量:①最大,故C错误;D、醋酸是弱酸,加水稀释后能促进醋酸的电离,所以①、②稀释后溶液的pH:7>②>①;氨水是弱碱,加水稀释后能促进氨水的电离,所以③、④、稀释后溶液的pH:③>④>7,所以向等体积的四种溶液中分别加入100mL水后,溶液的pH:③>④>②>①,故D错误。
本题难度:简单
3、选择题 由一价离子组成的四种盐:AC、BD、AD、BC的1mol/L的溶液,在室温下前两种溶液的pH=7,第三种溶液的pH>7,最后一种溶液的pH<7,则( )
| A | B | C | D 碱性 AOH>BOH AOH<BOH AOH>BOH AOH<BOH 酸性 HC>HD HC>HD HC<HD HC<HD |
参考答案:A
本题解析:
本题难度:一般
4、填空题 (10分)A、B代表不同物质,都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合。要求:相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度,且B2溶液中只有阳离子发生水解反应(已知:HNO2是弱酸)。
(1)写出化学式A1__________,A2_____ _____,B1__________,B2__________;
_____,B1__________,B2__________;
(2)相同温度下,当A1、B1的物质的量浓 度相等时,两溶液中水电离出的氢离子的物质的量浓度之比为_______________________?_;
度相等时,两溶液中水电离出的氢离子的物质的量浓度之比为_______________________?_;
(3)写出0.1 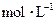 的
的 溶液中离子浓度大小排序?________________;
溶液中离子浓度大小排序?________________;
参考答案:(4)B1溶液中水的电离程度小于B2溶液中水的电离程度,原因是?________________。(1)NaOH 
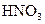
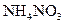 ?(各1分)?
?(各1分)?
(2)1∶1?(3)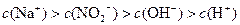
(4)硝酸电离的氢离子抑制了水的电离,铵根离子的存在促进了水的电离
本题解析:略
本题难度:一般
5、选择题 下列物质属于电解质的是
A.Cu
B.N2
C.KNO3
D.C2H5OH
参考答案:C
本题解析:电解质研究的对象是化合物,是在水溶液或熔融状态能导电的化合物。AB为单质,D的水溶液不导电。KNO3是强电解质。
本题难度:简单