时间:2017-11-11 03:15:17
1、填空题 Ⅰ.电离平衡常数(用K表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数 (K) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |

 SO2Cl2(l) ?△ H=–97.3kJ·mol—1
SO2Cl2(l) ?△ H=–97.3kJ·mol—1参考答案:Ⅰ. (1)①④②③(或①>④>②>③,用物质名称表示也对)(2分) (2)BC(2分)
(3)HF(aq) 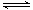 H+(aq) +F—(aq) △H=-(a-b)KJ·mol—1(2分,不写可逆号扣1分)
H+(aq) +F—(aq) △H=-(a-b)KJ·mol—1(2分,不写可逆号扣1分)
(4)1(2分)
Ⅱ.(1)K=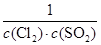 (2分) 2)d(2分)(3)bd(2分)
(2分) 2)d(2分)(3)bd(2分)
(4)7.616g<m(SO2)<15.232g(2分)
本题解析:Ⅰ.(1)根据越弱越水解,电离常数越小,盐水解时碱性越强,碳酸的二级电离常数最小,所以①碱性最强,其次是④,再次是②,最小是③;(2)A、HF溶液中对水的电离起抑制作用,NaF溶液中对水的电离起促进作用,因此由水电离出的c(H+)不相等,错误;B、①点时pH=6,根据电荷守恒C(Na+)+C(H+)=C(F-)+C(OH-),c(F-)-c(Na+)= C(H+)- C(OH-)=10-6-10-8=9.9×10-7mol/L,正确;C、②点时,pH=7,溶液呈中性,C(H+)=C(OH-),因此溶液中的c(F-)=c(Na+),正确;D、③点时V=20mL,恰好完全反应得到NaF溶液,c(F-)<c(Na+)=0.05mol·L—1,错误,选择BC;(3)根据盖斯定律,①-②可得HF(aq) 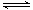 H+(aq) +F—(aq) △H=-(a-b)KJ·mol—1(4)H—O—F中F非金属性强,共用电子对偏向它,带负电荷-1,H带正电荷+1,O显0价,HFO+H2O=HF+H2O2,生成1molHF转移1摩尔电子。Ⅱ.(2)该反应是放热反应,要使K增大,只能降低温度,降温反应速率降低,所以选d;(3)a、υ(Cl 2)=υ(SO2)在任何条件下都相等,错误;b、方程左右两边气体分子系数差不等0,所以压强不再改变说明气体物质的量不再变化,达到平衡,正确;c、二者浓度1:1,不能说明它的浓度不再发生变化,错误;d、氯气有颜色,颜色不变,说明浓度不再发生变化,说明达到平衡,正确。(4)平衡体系中,再加入16.20g SO2Cl2,浓度变为原来的2倍,等于增大压强,平衡正向移动,但是不能抵消改变,所以比原来的大,但比2倍的少,7.616g<m(SO2)<15.232g
H+(aq) +F—(aq) △H=-(a-b)KJ·mol—1(4)H—O—F中F非金属性强,共用电子对偏向它,带负电荷-1,H带正电荷+1,O显0价,HFO+H2O=HF+H2O2,生成1molHF转移1摩尔电子。Ⅱ.(2)该反应是放热反应,要使K增大,只能降低温度,降温反应速率降低,所以选d;(3)a、υ(Cl 2)=υ(SO2)在任何条件下都相等,错误;b、方程左右两边气体分子系数差不等0,所以压强不再改变说明气体物质的量不再变化,达到平衡,正确;c、二者浓度1:1,不能说明它的浓度不再发生变化,错误;d、氯气有颜色,颜色不变,说明浓度不再发生变化,说明达到平衡,正确。(4)平衡体系中,再加入16.20g SO2Cl2,浓度变为原来的2倍,等于增大压强,平衡正向移动,但是不能抵消改变,所以比原来的大,但比2倍的少,7.616g<m(SO2)<15.232g
本题难度:困难
2、选择题 (2014届江苏省南通市高三第二次调研化学试卷)
如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是
A.分子组成为Cm(H2O)n的物质一定是糖类
B.微生物所在电极区放电时发生还原反应
C.放电过程中,H+从正极区移向负极区
D.正极反应式为:MnO2+4H++2e—=Mn2++2H2O
参考答案:D
本题解析:
A、原先认为糖均为碳水化合物,符合上式,但后来发现许多糖不符合该式,如鼠李糖(C6H12O5)、脱氧核糖(C5H10O4)等,也有符合该式的不是糖,如甲醛、乙酸(C2H4O2)、乳酸(C3H6O3)等错误;B、微生物放电,糖中碳元素化合价升高失去电子,为负极发生氧化反应,错误;C、原电池中阴离子向负极移动,阳离子向正极移动,错误;D、正确。
本题难度:一般
3、填空题 如图为Zn-Cu原电池的示意图,请回答:
(1)锌片为原电池的______(填“正”或“负”)极,该极的电极反应式是______.该反应属于______(填“氧化”或“还原”)反应.
(2)______(填“电子”或“电流”)从锌片通过导线流向铜片,溶液中H+的从______(填“锌片”或“铜片”)获得电子.
(3)原电池工作一段时间后,H2SO4溶液的浓度______(填“增大”或“减小”,下同),烧杯中溶液的质量______.
(4)若锌片质量减轻6.5g,则另一极放出气体的体积为______L(标准状况).
参考答案:2(1)锌比铜活泼,应为原电池的负极,发生氧化反应,电极方程式为Zn-2e-=Zn2+,故答案为:负;Zn-2e-=Zn2+;氧化;
(2)原电池工作时,电子从锌片(负极)通过导线流向铜片(正极),铜为原电池的正极,发生还原反应,电极方程式为2H++2e-=H2↑,可知溶液中H+的从铜片获得电子,故答案为:电子;铜片;
(3)电池总反应为Zn+2H+=Zn2++H2↑,由反应的方程式可知,原电池工作一段时间后,H2SO4溶液的浓度变小,溶液质量增大,故答案为:减小;增大;
(4)若锌片质量减轻6.5g,n(Zn)=0.1mol,转移电子0.2mol,则生成氢气0.1mol,体积为2.24L,故答案为:2.24.
本题解析:
本题难度:一般
4、选择题 用酸性氢氧燃料电池为电源进行电解的实验装置如下图所示。下列说法正确的是( )
A.燃料电池工作时,正极反应为:O2+ 2H2O + 4e- ="==" 4OH-
B.若a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C.若a、b极都是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等
D.若a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
参考答案:D
本题解析:原电池中负极失去电子,发生氧化反应,正极得到电子,发生还原反应,因此在该燃料电池中氢气在负极通入,氧气在正极通入,则A、该燃料电池的电解质显酸性,则燃料电池工作时,正极反应为:O2+ 4H++ 4e- ===2H2O,A不正确;B、a极与燃料电池的正极相连,因此若a极是铁,b极是铜时,铁是阳极,铜是阴极,a极逐渐溶解,B不正确;C、若a、b极都是石墨,a电极是阳极,溶液中的氢氧根放电产生氧气,在相同条件下a极产生的气体与电池中消耗的H2体积不相等,后者是前者的2倍,C不正确;D、若a极是粗铜,b极是纯铜时,则相当于粗铜的精炼,所以a极逐渐溶解,b极上有铜析出,D正确,答案选A。
本题难度:一般
5、选择题 钢铁发生腐蚀时,正极上发生的反应是
A.2Fe-4e- = 2Fe2+
B.2Fe2++4e- = 2Fe
C.2H2O+O2+4e-= 4OH-
D.Fe3++e-= Fe2+
参考答案:C
本题解析:钢铁腐蚀分为吸氧腐蚀和析氢腐蚀,吸氧腐蚀的正极反应为2H2O+O2+4e-= 4OH-?,析氢腐蚀的正极反应为2H++2e-=H2。
本题难度:一般