时间:2017-11-11 03:15:17
1、选择题 将铁棒和锌棒用导线连接插入硫酸铜溶液中,当电池中有0.4 mol电子通过时,负极的质量变化是
A.增加6.5g
B.减少5.6g
C.增加11.2g
D.减少13g
2、选择题 根据下图所示的装置(甲中电极均为惰性电极),判断下列叙述中正确的是
[? ]
A.利用该反应可持续产生硫酸铜直至硫酸耗尽
B.甲中a电极的电极反应为: O2+4H++4e-=2H2O
C.装置开始工作初期乙中的总反应为: Cu+H2SO4 CuSO4+H2↑
CuSO4+H2↑
D.反应过程中甲、乙装置中溶液的pH都逐渐减小
3、选择题 关于原电池的叙述正确的是?
[?]
A.构成原电池的正极和负极必须是两种不同金属
B.在理论上可将该反应:CH4(g)+2O2(g)→CO2(g)+H2O(l) ΔH<0,设计成原电池
C.在铅、银和盐酸构成的原电池工作时,铅板上有5.175 g铅溶解,正极上就有1 120 mL(标准状况)气体析出
D.原电池工作时,正极和负极上发生的都是氧化还原反应
4、填空题 (8分)现有如下两个反应:
(A)NaOH + HCl="===" NaCl + H2O?(B)Zn + CuSO4 = ZnSO4 + Cu
(1)根据两反应本质, 判断能设计成原电池的是?。
(2)根据你的选择完成下列问题:
正极材料:?;负极材料:?
电解质:?。
正极反应式为:?
负极反应式为:?
5、选择题 铜锌原电池(如图)工作时,下列叙述正确的是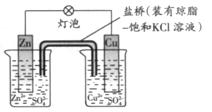 ?
?
A 正极反应为:Zn—2e-=Zn2+? B电池反应为:Zn+Cu2+=Zn2+ +Cu?
正极反应为:Zn—2e-=Zn2+? B电池反应为:Zn+Cu2+=Zn2+ +Cu?
C 在外电路中,电子从正极流向负 极?D 盐桥中的K+移向ZnSO4溶液?
极?D 盐桥中的K+移向ZnSO4溶液?