时间:2017-11-11 03:09:33
1、选择题 下列实验操作能使实验结果偏低的是( )
A.用蒸馏水润湿的pH试纸所测定的某酸溶液的pH
B.用容量瓶配制溶液,定容后摇匀液面下降,再加蒸馏水至刻度线所配制的溶液浓度
C.用仰视量筒刻度量取的一定量浓硫酸所配制的0.1mol?L-1H2SO4溶液的浓度
D.用待测液润洗的锥形瓶进行中和滴定所测定的待测液浓度
参考答案:A、用蒸馏水润湿的pH试纸,相当于将酸液稀释,所测定的某酸溶液的pH偏高,故A错误;
B、容量瓶配制溶液,定容后摇匀液面下降再加水,相当于将所配溶液稀释了,实验结果偏低,故B正确;
C、用仰视量筒刻度量取的一定量浓硫酸,量取的浓硫酸体积偏大,所配制的0.1mol?L-1H2SO4溶液的浓度偏高,故C错误;
D、用待测液润洗的锥形瓶,相当于待测液量偏多,会使标准液加入偏多,根据c待=c标V标V待,V标变大,c待偏大,即待测液浓度偏大,故D错误.
故选B.
本题解析:
本题难度:一般
2、填空题 用98%的浓H2SO4(ρ=1.84g/cm3)配制500ml0.5mol/L的稀H2SO4,请按要求填空:
(1)所需浓H2SO4的体积为______
(2)实验室除用到量筒、烧杯、玻璃棒外,实验中还需要用到的仪器有______.
(3)若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低、无影响)
①浓硫酸溶解后未冷至室温即进行定容______.
②定容时俯视刻度线______.
(4)若定容时液面高于刻度线应采取的措施是______.
参考答案:(1)浓H2SO4的物质的量浓度c=1000×1.84×98%98mol/L=18.4mol/L,
根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=500mL×0.5mol/L,
解得:x≈13.6,所以应量取的浓硫酸体积是13.6mL,
故答案为:13.6mL;?
(2)配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取(用到胶头滴管)称量,在烧杯中稀释,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:胶头滴管、500mL容量瓶.
故答案为:胶头滴管、500mL容量瓶;
(3))①浓硫酸溶解后未冷至室温即进行转移、定容,一旦冷却下来会导致体积偏小,浓度偏高,故答案为:偏高;
②定容时俯视刻度线,溶液体积偏小,浓度偏高,故答案为:偏高;
(4)因实验操作过程中一旦出现错误必须重新配制,故答案为:重新配制.
本题解析:
本题难度:简单
3、简答题 用18mol/L?浓硫酸配制100ml?3.0mol/L?稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积?②量取一定体积的浓硫酸?③溶解?④转移、洗涤?⑤定容、摇匀;回答下列问题
(1)所需浓硫酸的体积是______,量取浓硫酸所用的量筒的规格是______(从下列中选用)
A.10ml?B.25ml?C.50ml?D.100ml
(2)下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
A、所用过的烧杯、玻璃棒未洗涤______
B、定容时俯视溶液的液凹面______.
参考答案:(1)设浓硫酸的体积为V,18mol/L×V=0.1L×3.0mol/L,V=0.0167L=16.7mL;选取量筒的容积应稍大于或等于量取溶液的体积,故选B.
故答案为:16.7ml;B;
(2)A、所用过的烧杯、玻璃棒未洗涤,导致溶质的物质的量偏小,配制的溶液浓度偏小;?
B、定容时俯视溶液的液凹面,导致溶液的体积偏小,所以配制溶液的浓度偏大;
故答案为:偏小;偏大.
本题解析:
本题难度:一般
4、选择题 在配制一定物质的量浓度的溶液时,不会用到的仪器是
[? ]
A.烧杯
B.烧瓶
C.容量瓶
D.玻璃棒
参考答案:B
本题解析:
本题难度:简单
5、简答题 某环保兴趣小组在处理污水样品时,需用质量分数为36.5%的浓盐酸(密度为1.19g/cm3)配制成250mL0.1mol?L-1的盐酸溶液.
(1)在图中所示仪器中,配制上述溶液不需要的是______(填如图相应仪器的序号).除图中已有仪器外,配制上述溶液还需要的玻璃仪器是______,其作用按使用的先后顺序分别?是______和______.
(2)根据计算,下列量程或规格中,本实验量筒应使用的是______,容量瓶应使用的是______.(在横线上填写相应的序号)
A.10mL?B.100mL?C.250mL?D.500mL
(3)在量取浓盐酸后,下列操作的先后顺序是(用编号表示)______.
①待稀释的盐酸温度与室温一致后,沿玻璃棒注入所选定规格的容量瓶中.
②往容量瓶中小心加蒸馏水至液面接近环形刻度线1~2cm处,改用胶头滴管加蒸馏水,使凹液面最低处与瓶颈的环形刻度线相切.
③在盛浓盐酸的烧杯中注入适量蒸馏水,并用玻璃棒搅动,使其混合均匀.
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶.
(4)在容量瓶的使用方法中,下列操作正确的是______.
A.使用容量瓶前应检查它是否漏水
B.容量瓶用水洗净后,再用配好的稀HCl溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线
D.配制溶液时,若试样是液体,用量筒取试样后直接倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转,摇匀
(5)假设配制时其他操作均正确,只出现以下某一情况,所配制的溶液浓度偏高的是______.
①容量瓶中有少量蒸馏水,未干燥即将溶液转入
②烧杯和玻璃棒没有用蒸馏水洗涤2~3次
③量取浓盐酸后的量筒用蒸馏水洗涤2~3次,并将洗涤液倒入盛浓盐酸的烧杯
④定容时俯视容量刻度.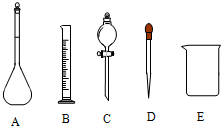
参考答案:(1)分液漏斗用来萃取和分液,配制一定物质的量浓度溶液不用分液漏斗,故选C;稀释时用玻璃棒搅拌,转移液体时用玻璃棒引流,
故答案为:C;玻璃棒;搅拌;引流;
(2)质量分数为36.5%的浓盐酸(密度为1.19g/cm3)的物质的量浓度为:C=1000pwM=1000×1.19×36.5%36.5=11.9(mol/L),所需浓盐酸体积V=0.25L×0.1mol/L11.9mol/L=0.0021L=2.1mL,故选择10mL量筒,配制250mL溶液,应选择250mL的容量瓶,故答案为:A、C;
(3)量取浓盐酸后,要进行稀释、冷却、转移、洗涤、定容等步骤,故答案为:③①④②;
(4)容量瓶使用时,应先检查是否漏水,然后用蒸馏水洗涤干净即可,不能用所配制溶液润洗,故A正确,B错误;
容量瓶只能用来配制溶液,不能在容量瓶中溶解或稀释,故CD错误;
摇匀时,盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转,故E正确,
故选AE;
(5)根据根据C=nV分析误差,①容量瓶中有少量蒸馏水,未干燥即将溶液转入,不影响浓度;
②烧杯和玻璃棒没有用蒸馏水洗涤2~3次,造成溶质减少,n减少,导致浓度偏低;
③量取浓盐酸后的量筒用蒸馏水洗涤2~3次,并将洗涤液倒入盛浓盐酸的烧杯,导致溶质增多,n 增大,浓度偏高;
④定容时俯视容量刻度,导致液体体积低于刻度线,V减少,导致浓度偏高.
故选③④.
本题解析:
本题难度:一般