时间:2017-11-11 03:09:33
1、选择题 实验室用98%的浓硫酸(密度为1.84g/mL)配制0.5mo1/L硫酸溶液500mL,不需要使用的仪器是( )
A.500?mL容量瓶
B.25?mL量筒
C.烧杯
D.天平
参考答案:D
本题解析:
本题难度:简单
2、选择题 配制100 ml 2.0 mol/L NaCl溶液时,下列情况中会导致最终浓度偏大的是
[?]
A、定容时,不小心加水超过了刻度线后,用胶头滴管吸出部分溶液至刻度线
B、容量瓶使用前未干燥
C、转移溶液后,烧杯没有洗涤
D、在称量NaCl固体时,天平指针偏左
参考答案:D
本题解析:
本题难度:简单
3、填空题 实验室用密度为1.84g/cm3、溶质质量分数为98%的浓硫酸来配制250mL?1.0mol/l?的稀硫酸,
请回答下列问题:
(1)配制250mL?1.0mol/L的硫酸溶液需浓硫酸______ml.
(2)选用的量筒的规格应是______ml.
(3)配制时,其正确的操作顺序是(用字母表示)______.
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.先加入少量水(约70mL)倒入烧杯中,用玻璃棒慢慢搅动再用量筒准确量取所需的一定体积的浓硫酸,缓缓倒入烧杯中,并且不断______(填操作名称),使其混合均匀;
C.将已冷却的硫酸沿玻璃棒注入______中,
D.将容量瓶盖紧,振荡,摇匀;
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
(4)操作A中,将洗涤液都移入容量瓶,其目的是______,溶液注入容量瓶前需恢复到室温,这是因为______.
(5)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若加蒸馏水时不慎超过了刻度线______;若定容时俯视刻度线______,若量取浓硫酸时仰视量筒______.
(6)若实验过程中出现如下情况如何处理?
向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面______.
参考答案:(1)浓H2SO4的物质的量浓度c=1000×1.84×98%98mol/L=18.4mol/L.根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=250mL×1mol/L,解得:x≈13.6.
故答案为:13.6.?
(2)所需浓硫酸的体积为13.6mL,所以选择20mL量筒.
故答案为:20.
(3)操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用20mL量筒量取(用到胶头滴管),在烧杯中稀释,用玻璃棒搅拌,冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.
所以实验操作步骤的正确顺序为BCAFED.
故答案为:步骤顺序为BCAFED;B填搅拌;C填250mL容量瓶.
(4)烧杯、玻璃棒上都沾有硫酸,所以应将洗涤液移入容量瓶中,以减少误差.
浓硫酸稀释,放出大量的热,会影响溶液体积,造成实验误差.
故答案为:将洗涤液中的硫酸移入容量瓶中,以减少误差;
浓硫酸稀释,放出大量的热,会影响溶液体积,造成实验误差.
(5)若加蒸馏水时不慎超过了刻度线,导致溶液体积偏大,所配溶液浓度偏低;
若定容时俯视刻度线,使溶液的体积偏低,所以溶液浓度偏高;
若量取浓硫酸时仰视量筒,量取浓硫酸的体积偏大,所配溶液浓度偏高.
故答案为:偏低;偏高;偏高.
(6)向容量瓶中转移溶液时,不慎有液滴掉在容量瓶外面,导致所配溶液浓度偏低,应宣告实验失败,洗净容量瓶后重新配制.
故答案为:应宣告实验失败,洗净容量瓶后重新配制.
本题解析:
本题难度:一般
4、实验题 实验室需要480 mL 0.4 mol·L-1 的NaCl溶液,有如下操作步骤:
①把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶解
②把①所得溶液小心转入一定容积的容量瓶中
③继续向容量瓶中加蒸馏水至液面距刻度线1 cm~2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀
⑤将容量瓶瓶塞塞紧,充分摇匀
请填写下列空白:
(1)操作步骤的正确顺序为(填序号)_______________。
(2)实验室有如下规格的容量瓶:①100 mL,②250 mL,③500 mL,④1 000 mL,本实验选用________。
(3)本实验用到的基本实验仪器除容量瓶、玻璃棒外还有:_________________。
(4)需要使用玻璃棒的操作有________(填序号),其作用为_________________。
(5)误差分析:(填“偏高”、“偏低”或“无影响”)
①称量NaCl时,物码倒置(1g以下用游码)________。
②某同学观察液面的情况如图所示,对所配溶液浓度将有何影响?________。 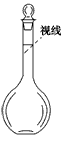
③没有进行操作步骤④________
④加蒸馏水时不慎超过了刻度线,立即用胶头滴管将多余的水吸出__________
⑤容量瓶原来有少量水___________
参考答案:(1)①②④③⑤
(2)③
(3)天平、药匙、烧杯、胶头滴管、量筒
(4)①②③④;①:搅拌,促进溶解、②③④:引流
(5)①偏低;②偏高;③偏低;④偏低;⑤无影响
本题解析:
本题难度:一般
5、实验题 配制1.50mol·L-1的NaOH溶液100mL:
(1)某学生操作如下:
①用托盘天平称出6.00g氢氧化钠:将天平调好零点,再在两盘上各取一张同样质量的纸,把游码调到1.00g的位置上,再于左盘放粒状氢氧化钠,右盘放上砝码至天平平衡,取下称好的氢氧化钠,并撤掉两盘上的纸。
②把称好的氢氧化钠放入一只100mL的烧杯中,加入约10mL水,搅拌使之溶解,溶解后立即用玻璃棒引流将溶液移至一只100mL的容量瓶内,加水至离刻度线约2cm处,用滴管加水至刻度线。
③写出一个标有配制日期的“0.25mol·L-1NaOH溶液”的标签,贴在容量瓶上密闭保存。指出上述操作中的7处错误
①__________________________;②_________________________
③__________________________;④_________________________
⑤__________________________;⑥_________________________
⑦__________________________
(2)下列操作造成所配溶液浓度偏高的是_______________
A.所用NaOH已经潮解;
B.用带游码的托盘天平称NaOH时误用了“左码右物”方法
C.未润洗溶解用的烧杯里;
D.未冷却到室温就注入容量瓶
E.定容时,俯视视刻度线;
F.托盘天平的砝码已生锈
参考答案:(1)①NaOH应放在干燥的烧杯中称量;②用过的游码未拨回原处;③托盘天平只能称出0.1g,称不出1.00g;④烧杯和玻璃棒未洗涤,洗涤液也应转入容量瓶;⑤溶解NaOH应冷却后再转移至容量瓶中;
⑥容量瓶中的溶液未摇匀;⑦配好的溶液应及时转移到有胶塞的试剂瓶内
(2)DEF
本题解析:
本题难度:一般