时间:2017-11-11 03:00:38
1、选择题 下列各变化中属于原电池反应的是
A.在空气中金属铝表面迅速氧化形成保护层
B.镀锌铁表面有划损时,也能阻止铁被氧化
C.红热的铁丝与冷水接触,表面形成蓝黑色保护层
D.浓硝酸比稀硝酸更能氧化金属铜
参考答案:B
本题解析:属于原电池反应,说明符合原电池的构成条件,原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应。A、铝直接通过化学反应被氧化成一层致密的氧化物保护膜,不符合原电池的构成条件,所以该反应不是电极反应,故A错误;B、Zn、Fe与电解质溶液构成原电池,Zn失电子从而Fe受到保护,所以该反应是电极反应,故B正确;C、铁与水直接反应生成了氧化物,不符合原电池的构成条件,所以该反应不是电极反应,故C错误;D、浓HNO3比稀HNO3的氧化能力强,故更能氧化金属铜,不符合原电池的构成条件,所以该反应不是电极反应,故D错误。
本题难度:一般
2、选择题 将镁片、铝片平行插入到一定浓度的NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述正确的是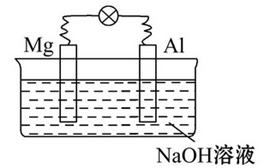
A.镁比铝活泼,镁失去电子被氧化成Mg2+
B.该装置开始工作时,铝片表面的氧化膜可不必处理
C.该装置的内、外电路中,均是电子的定向移动形成电流
D.铝是电池的负极,开始工作时溶液中会立即有白色沉淀生成
参考答案:B
本题解析:由图知道,Al被氧化,所以Al为负极,Mg为正极。A错误,Mg并没有失去电子,B正确,因为铝片表面的氧化膜可以溶于氢氧化钠溶液;C错误,在外电路中是,电子的定向移动形成电流,在内电路中是离子的移动形成电流;D错误,铝是电池的负极,开始工作时溶液中不会立即有白色沉淀生成。
点评:本题考查了原电池的基础知识,属于对基本知识的考查,该题的命题方式是高考命题的热点,本题难度是适中。
本题难度:一般
3、选择题 我国拥有完全自主产权的氢氧燃料电池车在奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液。下列有关电池的叙述不正确的是
A.正极反应式为:O2+2H2O+4e- == 4OH-
B.用该电池电解CuCl2溶液,产生2.24LCl2(标况)时,有0.1mol电子转移
C.该燃料电池的总反应方程式为:2H2+O2==2H2O
D.工作一段时间后,电解液中的KOH的物质的量不变
参考答案:B
本题解析:氧气得到电子,在正极通入,A正确;标准状况下2.24L氯气的物质的量是0.1mol,转移电子的物质的量是0.1mol×2=0.2mol,B不正确;负极是氢气失去电子,因此总的反应式就是2H2+O2==2H2O,C正确;根据总的反应式可知,氢氧化钾的物质的量是不变的,但浓度是降低,D正确,答案选B。
考点:考查原电池的有关判断和计算等
点评:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应,据此可以进行有关的判断和计算。
本题难度:困难
4、选择题 如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
在卡片上,描述合理的是( )
A.①②③
B.③④⑤
C.④⑤⑥
D.②③④
参考答案:①Zn为负极,Cu为正极,故①错误;
②H+向正极移动,故②错误;
③电子由Zn电极流向Cu电极,故③正确;
④Cu电极上发生2H++2e-=H2↑,故④正确;
⑤由2H++2e-=H2↑可知,有1mol电子流向导线,产生氢气0.5mol,故⑤正确;
⑥正极反应为2H++2e-=H2↑,故⑥错误;
故选B.
本题解析:
本题难度:一般
5、选择题 芬兰籍华人科学家张霞昌研制的“超薄型软电池”获2009年中国科技创业大赛最高奖,被称之为“软电池”的纸质电池总反应为:Zn+2MnO2+H2O = ZnO+2MnOOH。下列说法正确的是
[? ]
A.该电池中Zn作负极,发生还原反应
B.该电池反应中MnO2起催化作用
C.该电池工作时电流由Zn经导线流向MnO2
D.该电池正极反应式为:2MnO2+2e-+2H2O = 2MnOOH +2OH-
参考答案:D
本题解析:
本题难度:一般