时间:2017-11-11 02:33:41
1、选择题 莫尔盐[(NH4)2Fe(SO4)2·6H2O]常作氧化还原滴定法的基准物质,下列有关该盐溶液的比较,不正确的是( )
A.c(SO )>c(NH
)>c(NH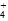 )>c(Fe2+)>c(H+)>c(OH-)
)>c(Fe2+)>c(H+)>c(OH-)
B.c(SO )=c(NH
)=c(NH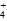 )>c(Fe2+)>c(H+)>c(OH-)
)>c(Fe2+)>c(H+)>c(OH-)
C.2c(SO )+c(OH-)=c(NH
)+c(OH-)=c(NH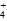 )+2c(Fe2+)+c(H+)
)+2c(Fe2+)+c(H+)
D.c(NH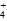 )+c(NH3·H2O)=2c(Fe2+)+2c[Fe(OH)2]
)+c(NH3·H2O)=2c(Fe2+)+2c[Fe(OH)2]
2、选择题 某一密闭绝热容器中盛有饱和Ca(OH)2溶液,当加入少量CaO粉末,下列说法正确的是
①有晶体析出 ②c[Ca(OH)2]增大 ③pH不变
④c(H+)·c(OH)-的积不变⑤c(H+)一定增大
A.①
B.①⑤
C.①②④
D.①③
3、选择题 在含有Mg(OH)2沉淀的饱和溶液中加入固体NH4Cl后,则Mg(OH)2沉淀
A.溶解
B.增多
C.不变
D.无法判断
4、选择题 常温下,浓度均为1.0 mol·L-1的NH3·H2O和NH4Cl混合溶液10 mL,测得其pH为9.3。下列有关叙述正确的是
A.加入适量的NaCl,可使c(NH4+) = c(Cl-)
B.滴加几滴浓氨水,c(NH4+)减小
C.滴加几滴浓盐酸,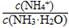 的值减小
的值减小
D.1.0 mol·L-1的NH4Cl溶液中c(NH4+)比该混合溶液大
5、选择题 将0.1mol下列物质置于1L水中,充分搅拌后,溶液中阴离子数最多的是:( )
A.KCl
B.Mg(OH)2
C.Na2CO3
D.MgSO4