时间:2017-11-11 02:33:41
1、实验题 (1)某兴趣小组在实验室探究工业合成硝酸的化学原理。
①氨的催化氧化:图a是探究氨的催化氧化的简易装置,实验中观察到锥形瓶中铂丝保持红热,有红棕色气体生成或白烟产生。白烟的成分是 (填化学式)。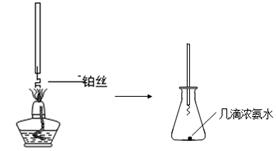
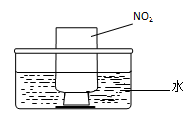
图a 图b
②NO2的吸收:如图b所示,将一瓶NO2倒置于水槽中,在水下移开玻璃片,可观察到的现象是 。
(2)三价铁盐溶液因Fe3+水解而显棕黄色,请以Fe(NO3)3溶液为例,设计实验探究影响盐类水解程度的因素。
①写出Fe(NO3)3水解的离子方程式 。
②参照示例完成下表实验方案的设计。
限选材料:0.05mol?L-1Fe(NO3)3、0.5mol?L-1Fe(NO3)3、1.0mol?L-1HNO3、1.0mol?L-1NaOH、NaHCO3固体、蒸馏水、冰水混合物;pH计及其他常见仪器。
| 可能影响因素 | 实验操作 | 预期现象和结论 |
| 溶液的酸碱性 | 取少量0.5mol?L-1Fe(NO3)3于试管中,加入几滴1mol?L-1HNO3。 | 棕黄色溶液颜色变浅,说明溶液酸性增强能抑制Fe(NO3)3的水解。 |
| 盐的浓度 | | |
| | | |
2、填空题 写出下列盐溶液的水解离子方程式:
(1)Fe(NO3)3 ;
(2)NaF ;
(3)K2CO3 ; ;
3、选择题 等体积、等物质的量浓度的NaCl和NaF溶液中,阴阳离子总数相比
A.前者多
B.后者多
C.一样多
D.无法判断
4、选择题 醋酸钡[(CH3COO)2Ba·H2O]是一种媒染剂,有关0.1 mol/L醋酸钡溶液中粒子浓度比较不正确的是
A.c(Ba2+)>c(CH3COO-)>c(OH-)>c(H+)
B.c(H+)+2c(Ba2+)=c(CH3COO-)+c(OH-)
C.c(H+)=c(OH-)-c(CH3COOH)
D.2c(Ba2+)=c(CH3COO-)+c(CH3COOH)
5、选择题 下列说法正确的是:
A.常温下醋酸分子不可能存在于pH>7的碱性溶液中
B.在0.1mol/LNa2SO3的溶液中加入少量NaOH固体,c(Na+)增大,c(SO32