时间:2017-11-11 02:29:43
1、选择题 pH=1的两种一元酸HX和HY的溶液,分别取50mL,加入足量的镁粉,充分反应,收集的氢气的体积分别为V(HX)和V(HY),若V(HX)>V(HY),下列说法正确的是
[? ]
A.HX一定是弱酸
B.HY一定是强酸
C.HX的酸性强于HY的酸性
D.反应开始时二者生成H2的速率不相同
参考答案:A
本题解析:
本题难度:一般
2、填空题 (3分)请自行设计实验,用至少两种方法证明盐酸的酸性比醋酸的酸性强?
可供选者选择的试剂:0.1mol/L的HCl 0.1mol/L的CH3COOH 0.1mol/L 的NaOH 0.1mol/L的CH3COONa CaCO3粉末 PH试纸 蒸馏水 酚酞试液 石蕊试液 玻璃仪器自行选择。
参考答案:
方法一:分别取两张PH试纸放在玻璃片上,用玻璃棒分别蘸取0.1mol/L的HCl 和0.1mol/L的CH3COOH 测PH,用标准比色卡对照。PH小的为强酸,PH大的为弱酸。
方法二:取等量CaCO3粉末于两只试管中,再分别加入等体积的0.1mol/L的HCl 和0.1mol/L的CH3COOH,反应较剧烈的为强酸,反应不太剧烈的为弱酸。 (任写出一种方法给3分)
本题解析:本题考察学生对于化学实验知识的掌握程度,以及学生自行设计实验方案的能力,属于开放性试题,对于学生的综合测评较为全面。
考点:化学实验以及仪器组装。
点评:本题属于实验开放题,在比较酸性强弱中有很多方法,可以测定同浓度溶液的pH,也可以利用强酸制弱酸来设计,答案不限。
本题难度:一般
3、选择题 1mL?pH值相同的醋酸和盐酸,分别用蒸馏水稀释到100mL,稀释后两溶液的pH?分别为m和n( )
A.m>n
B.m=n
C.m<n
D.不能确定
参考答案:C
本题解析:
本题难度:简单
4、填空题 对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。若25℃时有HA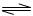 H++A―,则该弱酸的电离平衡常数的表达式为K=__________。下表是几种常见弱酸的电离平衡常数(25℃)。
H++A―,则该弱酸的电离平衡常数的表达式为K=__________。下表是几种常见弱酸的电离平衡常数(25℃)。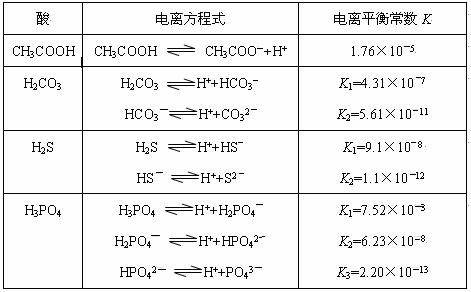
请回答下列各题:
(1)K只与温度有关,当温度升高时,K值______(填“增大”、“减小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?_______________。
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是_____________,最弱的是_____________。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律是K1:K2:K3≈1:10―5:10―10,产生此规律的原因是:________________________。
参考答案:K ="=" 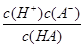 ?(1分)
?(1分)
(1)增大 (1分)
(2)K值越大,电离出的氢离子浓度越大,所以酸性越强 (2分)
(3)H3PO4(1分)? HPO42―(1分)
(4)上一级电离产生的H+对下一级电离有抑制作用 (2分)
本题解析:根据电离常数的定义式和电离方程式可得出电离平衡常数表达式。
(1)因为弱电解质的电离为吸热过程,所以温度升高,K值增大。
(2)K值越大,电离平衡向右进行的程度越大,电离出的氢离子浓度越大,所以酸性越强。
(3)K值越大,酸性越强,根据题目所给表中的数据,H3PO4?的电离常数最大,所以酸性最强,? HPO42―的电离常数最小,酸性最弱。
(4)上一级电离产生H+,对于下一级电离,相当于增加了生成物浓度,对电离起到了抑制作用。
本题难度:一般
5、填空题 (10分)
Ⅰ 浓度为0.1 mol·L-1的盐酸、硫酸、醋酸三种溶液,试回答:
(1)三种溶液中c(H+)依次为a mol·L-1,b mol·L-1,c mol·L-1,其由大到小的顺序是________。
(2)完全中和一定量NaOH溶液时,需上述三种酸的体积依次是V1L、V2L、V3L,其大小关系为__________________________________。
(3)与锌反应开始时产生氢气的速率分别为v1、v2、v3,其由大到小的顺序是________。
Ⅱ c(H+)相同的盐酸、硫酸、醋酸三种溶液,试回答:
(1)三种溶液均加水稀释至体积为原来的10倍, c(H+)依次为a mol·L-1,b mol·L-1,c mol·L-1,其由大到小的顺序是_______。
(2)三种溶液体积相同时,同时加入相同的锌,若产生相同物质的量的氢气,所需时间分别为t1、t2、t3,其大小关系是___________.
参考答案:Ⅰ⑴bac? ⑵V1=2V2=V3? ⑶bac Ⅱ⑴c>a="b" ⑵t1=t2>t3
本题解析:Ⅰ.
(1)盐酸c(H+)=0.1mol/L、硫酸c(H+)=0.2mol/L、醋酸c(H+)<0.1mol/L,故b>a>c。
(2)浓度相同的醋酸,盐酸,硫酸,三者的溶液中H+浓度关系为硫酸>盐酸>醋酸,因为硫酸为二元酸,H+浓度为盐酸电离出H+浓度的2倍,而醋酸为弱酸,部分电离所以H+浓度是最小的,但总的H+的浓度关系为盐酸=醋酸<硫酸,盐酸和硫酸为强酸完全电离,所以中和NaOH所需的酸的体积关系为醋酸=盐酸>硫酸,即V1=2V2=V3。
(3)与锌反应,反应速率与溶液中的H+的浓度有关,H+的浓度关系为硫酸>盐酸>醋酸,所以初始反应速率关系为硫酸>盐酸>醋酸,即v2>v1>v3。
Ⅱ.
(1)三种溶液均加水稀释至体积为原来的10倍, 盐酸、硫酸是强电解质完全电离,所以c(H+)都减小为原来的1/10,醋酸是弱电解质,加水稀释会有部分氢离子又电离处理,所以c(H+)不会减小到原来的1/10。故c(H+) 由大到小的顺序是c>a=b。
(2)三种溶液体积相同时,同时加入相同的锌,若产生相同物质的量的氢气,所需时间由于盐酸、硫酸c(H+)相等。所以t1=t2。醋酸是弱电解质,只有部分氢离子电离出来。随着反应的进行,会继续电离出氢离子。所以醋酸c(H+)会比盐酸、硫酸c(H+)大。故醋酸反应所需时间最短。t1=t2>t3。
点评:本题注意把握醋酸的部分电离对c(H+)的影响。
本题难度:一般