时间:2017-11-11 02:27:49
1、简答题 请写出以下物质或微粒的电子式:
H2O2______;Cl-______;?N2______;Ca2+______;MgCl2______;NaOH______.
参考答案:H2O2为共价化合物,书写共价化合物的电子式的书写:原子间通过共用电子对结合而成的,书写时将共用电子对画在两原子之间,每个原子的未成对电子和孤对电子也应画出,故答案为: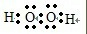
Cl-为简单阴离子,简单阴离子电子式的书写:一般非金属原子在形成阴离子时,得到电子,使最外层达到稳定结构,这些电子都应画出,并将符号用“[]”括上,右上角标出所带的电荷数,电荷的表示方法同于离子符号,故答案为: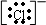
N2为共价非金属单质,共价非金属单质的电子式书写共价化合物是原子间通过共用电子对结合而成的,书写时将共用电子对画在两原子之间,每个原子的未成对电子和孤对电子也应画出,故答案为: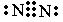
Ca2+为金属阳离子,金属阳离子的电子式:金属原子在形成阳离子时,最外层电子已经失去,但电子式仅画出最外层电子,所以在画阳离子的电子式时,就不再画出原最外层电子,但离子所带的电荷数应在元素符号右上角标出,所以金属阳离子的电子式即为离子符号,故答案为:Ca2+
MgCl2、NaOH为离子化合物,离子化合物的电子式:先根据离子电子式的书写方法,分别画出阴、阳离子的电子式,然后让阴、阳离子间隔排列,注意相同离子不能合并,故答案为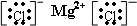
;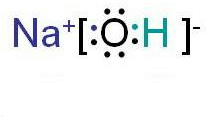
本题解析:
本题难度:一般
2、选择题 化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是
[? ]
A.硫原子的原子结构示意图: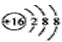
B.NH4Cl的电子式: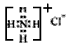
C.原子核内有10个中子的氧原子: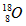
D.乙烯的结构简式:C2H4
参考答案:C
本题解析:
本题难度:简单
3、填空题 (12分)已知由短周期元素组成的五种常见化合物分子A、B、C、D、E,其所含原子数目依次为2、3、4、5、6,其中A、B、E各含18个电子,C、D各含10个电子。请回答:
(1)D中含有的化学键类型有?,若实验测得在25℃、101kPa时,8gD与O2完全燃烧,生成稳定化合物时放出445kJ的热量,则该反应的热化学方程式为?。
(2)室温下,向一定量C的稀溶液中逐滴加入A的稀溶液,有离子化合物XY4Z(X、Y、Z表示元素符号)生成,混合液pH变化如图所示。实验过程中,当pH=7时,下列关于混合液中离子浓度判断正确的是?。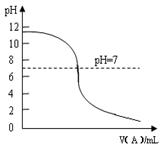
Ⅰ. c(XY+4)>c(Z—)>c(OH—)=c(H+)
Ⅱ. c(XY+4)=c(Z—),c(OH—)=c(H+)
Ⅲ. c(Z—)>c(XY+4)> c(OH—)=c(H+)
Ⅳ. c(XY+4) + c(H+) = c(Z—) + c(OH—)
(3)XY4Z溶液PH ?7(填“小于、等于、大于”),其原因用离子方程式表示为:?。
(4)将B缓慢通入Cu(OH)2悬浊液中,浑浊变为黑色,原因是?。
(5)E的核磁共振氢谱图中有两组峰,且峰覆盖的面积比为3︰1 ,E的结构式为:?。
参考答案:(12分)
(1)共价键(1分)
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=—890kJ·mol—1(2分)
(2)Ⅱ、Ⅳ(2分)
(3)小于(1分)NH+4? + H2O  ?NH3·H2O? + H+?(2分)
?NH3·H2O? + H+?(2分)
(4)CuS的溶解度小于Cu(OH)2的溶解度(2分)
(5)CH3-OH(2分)
本题解析:略
本题难度:简单
4、选择题 X、Y、Z、M是4种短周期元素,其中X、Y位于同一主族,Y与M,X与Z位于同一周期.X原子最外层电子数是其电子层数的3倍.Z原子的核外电子数比X原子少1.M是同周期中半径最大的元素(除稀有气体元素),下列说法正确的是( )
A.Y元素最高价氧化物对应水化物的化学式可表示为HYO3
B.氢化物的稳定性Z>X>Y
C.X、Y、Z元素的气态氢化物中,Y的沸点最高
D.四种元素简单离子的半径由大到小依次为Y>Z>X>M
参考答案:D
本题解析:
本题难度:一般
5、选择题 下列含有非极性键的共价化合物是( )
A.HCl
B.Na2O2
C.H2O2
D.H2
参考答案:C
本题解析:
本题难度:简单