时间:2017-11-11 02:22:23
1、选择题 下列离子方程式不正确的是
A.Cl2与稀NaOH溶液反应:Cl2+2OH-=Cl-+ClO-+H2O
B.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
C.烧碱溶液中加入铝片:2Al+2OH-+2H2O=2AlO2-+3H2↑
D.在稀氨水中通入过量CO2:NH3?H2O+CO2=NH4++HCO3-
参考答案:B
本题解析:分析:A、氯气和氢氧化钠反应生成氯化钠、次氯酸钠、水;
B、三价铁离子具有氧化性能氧化碘离子为碘单质;
C、铝和氢氧化钠反应生成偏铝酸钠和氢气;
D、过量二氧化碳反应生成碳酸氢铵;
解答:A、Cl2与稀NaOH溶液反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故A正确;
B、Fe(OH)3溶于氢碘酸,三价铁离子氧化碘离子,反应的离子方程式为:2Fe(OH)3+2I-+6H+=2Fe2++6H2O+I2,故B错误;
C、烧碱溶液中加入铝片反应生成偏铝酸钠和氢气,离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,故C正确;
D、在稀氨水中通入过量CO2,反应的离子方程式为:NH3?H2O+CO2=NH4++HCO3-,故D正确;
故选B.
点评:本题考查了离子方程式的正误判断和注意问题,主要考查三价铁离子具有氧化性能氧化碘离子,量不同产物不同的离子方程式的书写.
本题难度:简单
2、填空题 A、B、C、?D四种溶液分别是NaOH溶液、氨水、?CH3COOH溶液?、盐酸中的一种。常温下:
①浓度均为0.1mol/L的A和C溶液,pH:A<C<7;
②将1?L?pH=3的A溶液分别与0.001mol/L?xL?B溶液、0.001mol/L?yL?D溶液充分反应至中性,x、y大小关系为:?y<x;
回答下列问题:
(1)D是____________(填化学式)溶液;
(2)②中1LpH=3的A溶液与0.001mol/L xL?B溶液充分反应至中性,所得溶液中各种离子的物质的量浓度由大到小的顺序为________________。
(3)常温下,等体积且等物质的量浓度的C溶液和?D溶液充分混合后所得溶液的pH______7(填“>”、“<”或“=”),用离子方程式解释其原因___________________。
(4)向pH相同且等体积的两份溶液A和C中,分别投入质量不同的锌粉反应,若放出氢气的质量相同,则下列说法正确的是________(填写序号)。
①开始反应时的速率A>C?
②反应所需要的时间C>A?
③参加反应的锌粉物质的量A=C?
④A溶液里有锌粉剩余?
参考答案:(1)NaOH
(2)c(NH4+)=?c(Cl-)>?c(H+)=?c(OH-)
(3)>;CH3COO-+?H2O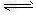 CH3COOH+?OH-
CH3COOH+?OH-
(4)③④
本题解析:
本题难度:一般
3、选择题 相同温度下等物质的量浓度的下列溶液中,pH值最小的是( )
A.NH4Cl
B.NH4HCO3
C.NH4HSO4
D.(NH4)2SO4
参考答案:C
本题解析:
本题难度:简单
4、选择题 下列溶液中微粒的物质的量浓度关系正确的是( )
A.NaHCO3溶液中:c(H+)+c(Na+)=c(OH-)+c(CO32-)+c(HCO3-)
B.pH=3的CH3COOH与pH=11的NaOH溶液等体积混合后的溶液中:c(H+)>c(OH-)
C.0.1mol/L的NH4Cl溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中:2c(Na+)=c(CH3COOH)+c(CH3COO-)
参考答案:BD
本题解析:
本题难度:一般
5、选择题 想一想:Ba(OH)2(固体)、CuSO4(固体)、CH3COOH(液态)这些物质为什么归为一类,下列哪些物质还可以和它们归为一类
[? ]
A.75%的酒精溶液
B.硝酸钠
C.Fe(OH)3胶体
D.豆浆
参考答案:B
本题解析:
本题难度:简单