时间:2017-11-11 02:17:47
1、选择题 下列叙述中正确的是
[? ]
A.晶胞是晶体中最小的重复结构单元
B.晶胞中的任何一个粒子都属于该晶胞
C.已知晶胞的组成就可推知晶体的组成
D.不同晶体中晶胞的大小和形状都相同
参考答案:AC
本题解析:
本题难度:简单
2、选择题 据报道,某种合金材料有较大的储氢容量,其晶体结构的最小单元如图所示。则这种合金的化学式为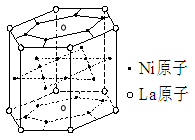
A.LaNi6
B.LaNi3
C.LaNi4
D.LaNi5
参考答案:D
本题解析:正确答案:D,La为12×1/6+2×1/2=3;Ni为18×1/2+6=15,所以化学式为LaNi5,选D。
本题难度:一般
3、选择题 下列有关晶胞的叙述正确的是(? )
A.晶胞是晶体中的最小的结构重复单元
B.不同的晶体中晶胞的大小和形状都相同
C.晶胞中的任何一个粒子都完全属于该晶胞
D.晶胞都是正方体
参考答案:A
本题解析:晶胞是晶体中的最小的结构重复单元,A正确;不同的晶体中晶胞的大小和形状不一定都相同,B不正确;晶胞中的任何一个粒子不一定都完全属于该晶胞,C不正确;晶胞不一定都是正方体,D不正确,答案选A。
点评:该题是基础性试题的考查,主要是考查学生对晶胞结构的了解掌握情况,意在巩固学生的基础,提高学生的能力,有利于培养学生的抽象思维能力和发散思维能力。
本题难度:简单
4、选择题 2001年报道硼和镁形成的化合物刷新了金属化合物超导的最高纪录。下图示意的是该化合物的晶体结构:镁原子间形成正六棱柱,且棱柱的上下底面还各有一个镁原子;6个硼原子位于棱柱内。则该化合物的化学式为 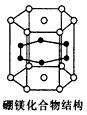
[? ]
A. MgB
B. MgB2
C. Mg2B
D. Mg3B2
参考答案:B
本题解析:
本题难度:一般
5、选择题 在金属晶体中,如果金属原子的价电子数越多,原子半径越小,自由电子与金属阳离子间的作用力越大,金属的熔沸点越高。由此判断下列各组金属熔沸点高低顺序正确的是(? )
A.Mg>Al>Ca
B.Al>Na>Li
C.Al>Mg>Ca
D.Mg>Ba>Al
参考答案:C
本题解析:A组中Mg、Al、Ca相比,半径最小的是Al,最大的是Ca,价电子数最多的是Al,Mg与Ca相等,因此熔沸点顺序应是Al>Mg>Ca。故A错误,C对。B组熔沸点顺序应为Al>Li>Na,B错误。D组熔点顺序应为Al>Mg>Ba,D错误。
本题难度:简单