时间:2017-11-11 02:15:48
1、填空题 难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下溶解平衡:
K2SO4·MgSO4·2CaSO4·2H2O(s) 2Ca2++2K++Mg2++4SO42-+2H2O。为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
2Ca2++2K++Mg2++4SO42-+2H2O。为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下: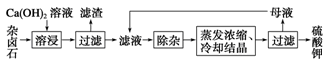
(1)滤渣主要成分有________和CaSO4以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:
?。
(3)“除杂”环节中,先加入?溶液,经搅拌等操作后,过滤,再加入?溶液调滤液pH至中性。
(4)不同温度下,K+的浸出浓度与溶浸时间的关系见右图。由图可得,随着温度升高,
①?,
②?,
③溶浸出的K+的平衡浓度增大。
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+CO32- CaCO3(s)+SO42-。已知298 K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,计算此温度下该反应的平衡常数,K=?。
CaCO3(s)+SO42-。已知298 K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,计算此温度下该反应的平衡常数,K=?。
参考答案:(1)Mg(OH)2(1分)?(2)加入Ca(OH)2溶液,Mg2+与OH-结合生成Mg(OH)2沉淀,Mg2+浓度减小,平衡正向移动,K+增多(2分)?(3)K2CO3(1分) ?H2SO4(1分)
(4)①溶浸平衡向右移动(1分)?②K+的溶浸速率增大(1分)?(5) K=1.75×104。(2分)
本题解析:(1)“呆矿”在水中存在沉淀溶解平衡K2SO4·MgSO4·2CaSO4·2H2O(s) 2Ca2++2K++Mg2++4SO42-+2H2O,为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,氢氧根离子和镁离子结合生成氢氧化镁沉淀,同时钙离子增多,析出硫酸钙沉淀,所以滤渣中主要成分为Mg(OH)2和CaSO4以及未溶杂卤石。
2Ca2++2K++Mg2++4SO42-+2H2O,为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,氢氧根离子和镁离子结合生成氢氧化镁沉淀,同时钙离子增多,析出硫酸钙沉淀,所以滤渣中主要成分为Mg(OH)2和CaSO4以及未溶杂卤石。
(2)Ca(OH)2溶液能溶解杂卤石浸出K+的原因是氢氧化钙是饱和溶液,加入后氢氧根离子和镁离子结合生成氢氧化镁沉淀,促进平衡右移,增多K+。
(3))“除杂”环节主要是除去钙离子,依据除杂原则不能引入新的杂质,根据制取的目的是制备硫酸钾,所以加入的试剂易于除去,不引入新的杂质,因此加入过量K2CO3除钙离子,过滤后加入硫酸至中性,除去碳酸钾即可。
(4)分析不同温度下,K+的浸出浓度与溶浸时间的关系,温度越高K+的浸出浓度越大,溶浸时间越短,反应速率越大,达到平衡越快,故图象中分析得到的结论为:①溶浸平衡向右移动;②K+的溶浸速率增大。
(5)溶浸过程中会发生反应CaSO4(s)+CO32- CaCO3(s)+SO42-,CaCO3(s)
CaCO3(s)+SO42-,CaCO3(s) Ca2++CO32-;CaSO4(s)
Ca2++CO32-;CaSO4(s) Ca2++SO42-;依据硫酸钙、碳酸钙溶度积常数的计算表达式,转化关系中钙离子相同计算,反应的平衡常数K=
Ca2++SO42-;依据硫酸钙、碳酸钙溶度积常数的计算表达式,转化关系中钙离子相同计算,反应的平衡常数K=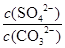 =
=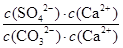 =
=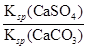 =
=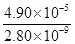 =1.75×104。
=1.75×104。
本题难度:一般
2、填空题 以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等。实验室模拟工业以硫酸渣制备铁红(Fe2O3),过程如下:
(1)硫酸渣的成分中属于两性氧化物的是 , 写出酸溶过程Fe2O3与稀硫酸反应的离子反应方程式: ;
(2)生产过程中,为了确保铁红的纯度,氧化过程需要调节溶液的pH的范围是_________;(部分阳离子以氢氧化物形式沉淀时溶液的pH见下表)
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
参考答案:32. (16分)(1) Al2O3 Fe2O3 + 6H+ ==2Fe3+ + 3H2O
(2)3.2—3.8 (3) SiO2 Al2(SO4)3 (4) 14m/15w
本题解析:(1)硫酸渣中含Fe2O3、SiO2、Al2O3、MgO,属于两性氧化物的是Al2O3,氧化铁是碱性氧化物,可以和硫酸反应生成硫酸铁和水,即Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,离子反应方程式为:Fe2O3 + 6H+ ==2Fe3+ + 3H2O(2)根据几种离子沉淀的pH,使Fe3+沉淀完全的PH为3.2,其他离子开始沉淀PH为3.8,因此所选PH需介于3.2和3.8之间;答案为:3.2~3.8,(3)因二氧化硅不与硫酸反应,“滤渣A”主要成份的化学式为SiO2.未沉淀的离子为Na+、Mg2+、Al3+,滤液B可以回收的物质有Na2SO4、Al2(SO4)3、MgSO4;(4)铁红制备过程中,铁元素损耗25%,,最终得到铁红的质量为m kg,铁元素的质量为(1000m×112/160)÷75%=14m/15,则原来硫酸渣中铁元素质量分数为14m/15w。
考点:考查物质的性质,离子方程式的书写,元素及其化合物的性质等知识。
本题难度:困难
3、填空题 (11分)电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为_________。
②下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是__________(填字母序号)。
a.滴加少量浓盐酸 b.微热溶液
c.加水稀释 d.加入少量醋酸钠晶体
(2)用0.1 mol·L-1NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
①滴定醋酸的曲线是_____(填“I”或“Ⅱ”)。
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是_____。
③V1和V2的关系:V1_____V2(填“>”、“=”或“<”)。
④M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_________。
(3)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN > AgI。
| 操作步骤 | 现象 |
| 步骤1:向2 mL 0.005 mol·L-1 AgNO3溶液中加入2 mL 0.005 mol·L-1 KSCN溶液,静置。 | 出现白色沉淀。 |
| 步骤2:取1 mL上层清液于试管中,滴加1滴2mol·L-1 Fe(NO3)3溶液。 | 溶液变红色。 |
| 步骤3:向步骤2的溶液中,继续加入5滴3 mol·L-1 AgNO3溶液。 | 现象a,溶液红色变浅。 |
| 步骤4:向步骤1余下的浊液中加入5滴3 mol·L-1 KI溶液。 | 出现黄色沉淀。 |
参考答案:(13分,未标分数的空,每空1分) (1)① CH3COOH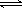 CH3COO-+H+ (2分)
CH3COO-+H+ (2分)
② b、c(2分,漏选得1分,错选不得分) (2)① I ② 0.1mol·L-1醋酸溶液
③ <④ c(CH3COO-)> c (Na+)> c (H+)> c (OH-) (3)① Fe3++3SCN- Fe(SCN)3(2分)
Fe(SCN)3(2分)
② 出现白色沉淀 ③ AgSCN(s)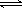 Ag+(aq)+SCN-(aq)(1分),加入KI后,因为溶解度:AgI<AgSCN,Ag+与I-反应生成AgI黄色沉淀:Ag++I-=AgI↓,AgSCN的溶解平衡正向移动(1分)。(2分)
Ag+(aq)+SCN-(aq)(1分),加入KI后,因为溶解度:AgI<AgSCN,Ag+与I-反应生成AgI黄色沉淀:Ag++I-=AgI↓,AgSCN的溶解平衡正向移动(1分)。(2分)
本题解析:(1)①醋酸是一元弱酸,在溶液中存在电离平衡,则醋酸在水溶液中的电离方程式为CH3COOH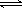 CH3COO-+H+。
CH3COO-+H+。
②a.滴加少量浓盐酸,氢离子浓度增大,抑制醋酸电离,电离程度减小,a错误;b.电离吸热,微热溶液促进电离,电离程度增大,b正确;c.加水稀释粗电离,电离程度增大,c正确;d.加入少量醋酸钠晶体,增大醋酸根浓度,抑制醋酸电离,电离程度减小,bc。
(2)①醋酸是弱酸,0.1mol/L醋酸溶液的pH大于1,则滴定醋酸的曲线是I。
②盐酸和氢氧化钠溶液均是一元的强酸和强碱,在浓度相等的条件下对水的电离程度影响是相同的。醋酸是一元弱酸,在浓度与盐酸相等的条件下,溶液中氢离子浓度小,对水的电离程度影响小于盐酸,则滴定开始前,三种溶液中由水电离出的c(H+)最大的是0.1mol/L醋酸。
③氢氧化钠和醋酸恰好反应时生成的醋酸钠水解溶液显碱性,要满足溶液显中性,则醋酸应该过量。而氢氧化钠与盐酸恰好反应时生成的氯化钠不水解,溶液显中性,所以V1小于V2。
④M点时醋酸过量,溶液是由等浓度的醋酸钠和醋酸构成的,溶液显酸性,则对应的溶液中,各离子的物质的量浓度由大到小的顺序是c(CH3COO-)> c (Na+)> c (H+)> c (OH-)。
(3)① 铁离子与KSCN溶液反应使溶液显红色,反应的离子方程式为Fe3++3SCN- Fe(SCN)3。
Fe(SCN)3。
②硝酸银溶液能与KSCN溶液反应产生白色沉淀,所以向步骤2的溶液中,继续加入5滴3 mol·L-1 AgNO3溶液时溶液中仍然会出现白色沉淀。
③根据以上分析可知溶液中存在平衡AgSCN(s)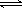 Ag+(aq)+SCN-(aq),加入KI后,因为溶解度:AgI<AgSCN,因此Ag+与I-反应生成AgI黄色沉淀:Ag++I-=AgI↓,从而导致AgSCN的溶解平衡正向移动。
Ag+(aq)+SCN-(aq),加入KI后,因为溶解度:AgI<AgSCN,因此Ag+与I-反应生成AgI黄色沉淀:Ag++I-=AgI↓,从而导致AgSCN的溶解平衡正向移动。
考点:考查弱电解质的电离平衡、盐类水解以及溶解平衡等
本题难度:一般
4、简答题 铬抗腐蚀性高,在钢中含量达到12%称为不锈钢.工业上冶炼铬的主要步骤如图所示:
试回答下列问题
(1)已如步骤Ⅱ的反应方程式为:
8Na2CrO4+6Na2S+23H2O→8Cr(OH)3↓十3Na2S2O3十22NaOH
该反应中氧化剂是______(填化学式),生成?lmolCr(OH)3时转移电子的物质的量为______mol.
(2)步骤IV中电解Cr2O3的阳极反应式为______,此时Cr2O3?的状态为______.
(3)常温下,铬能慢慢溶于稀盐酸、稀硫酸,但不溶于浓硝酸.其不溶于浓硝酸的原因可能是______.
(4)已如:2CrO42-+2H+
Cr2O72-+H2O
①25.C,KSP(Ag2Cr2O4)=1.12×10-12,KSP(Ag2Cr2O7)=2×10-7,往Na2Cr2O7溶液中加入AgNO3溶液,最终只生成一种砖红色沉淀,该沉淀的化学式是______.
②将wg固体Na2CrO4溶于适量水配成lL溶液,该溶液中有关粒子的浓度(mol?L-1)与pH的关系如下表:
由上表可知:
Ⅰ.要使溶液中CrO42-的量达到最大,应控制溶液的pH______(用>、<、=及相关数据表示).
Ⅱ. w g固体Na2CrO4的物质的量n=______(用数学表达式表示).
参考答案:(1)Cr化合价从+6→+3,化合价降低3,故Na2CrO4作氧化剂,生成?lmolCr(OH)3时转移电子的物质的量为 3mol.
故答案为:Na2CrO4 ?3.
(2)熔融状态时,Cr2O3?发生电离:Cr2O3═2Cr3++3O2-,电解Cr2O3的阳极反应式为:2O2--4e-═O2↑,
故答案为:2O2--4e-═O2↑ 液态(或熔融态).
(3)铬能慢慢溶于稀盐酸、稀硫酸,但不溶于浓硝酸,说明铬被浓硝酸氧化成致密的保护膜.
故答案为:表面生成致密氧化膜(或发生钝化).
(4)①因KSP(Ag2Cr2O4)=1.12×10-12,KSP(Ag2Cr2O7)=2×10-7,沉淀溶解平衡由溶解度小的向更小的方向转化,所以往Na2Cr2O7溶液中加入AgNO3溶液,最终只生成一种砖红色沉淀,该沉淀为:Ag2CrO4.
故答案为:Ag2CrO4.?
?②观察表中数据可知,PH增大,c(CrO42-)增大,PH=9时,c(CrO42-)=0.996,故要使溶液中CrO42-的量达到最大,应控制溶液的pH>9;
铬元素存在形式有:CrO42-、Cr2O72-、HCrO4-,根据物料守恒w g固体Na2CrO4的物质的量为:n═n(CrO42-)+c(Cr2O72-)+n(HCrO4-).
故答案为:Ⅰ.>9Ⅱ.n(CrO42-)+c(Cr2O72-)+n(HCrO4-).
本题解析:
本题难度:一般
5、选择题 下列实验操作正确的是( )
A.验证AgI溶解度比AgCl小,向AgCl悬浊液中滴加KI溶液
B.中和滴定实验时,用待测液润洗锥形瓶
C.测定食醋溶液pH时,用蒸馏水润湿pH试纸
D.测定中和热时,用普通玻璃棒快速搅拌反应液
参考答案:A、依据沉淀转化的条件是利用反应向更难溶的方向进行分析;验证AgI溶解度比AgCl小,向AgCl悬浊液中滴加KI溶液,沉淀颜色从白色变化为黄色,证明碘化银溶解度小于氯化银,故A正确;
B、中和滴定实验时,用待测液润洗锥形瓶会增大待测溶液的体积,多消耗标准液,引起实验误差;依据误差分析判断测得结果增大,故B错误;
C、PH试纸湿润后再测定食醋溶液PH会稀释待测溶液,测定的溶液PH会增大,故C错误;
D、环形玻璃棒在搅拌时是上下移动搅拌,不易于玻璃杯碰撞,但一般的玻璃棒容易与玻璃杯碰撞,造成热量的增长或损失;故D错误;
故选A.
本题解析:
本题难度:简单