时间:2017-11-11 02:11:57
1、选择题 用0.10 mo1/L的盐酸滴定0.10 mol/L的氨水,滴定过程中不可能出现的结果是
[? ]
A.c(NH4+)>c(Cl-),c(OH-)>c(H+)
B.c(NH4+)=c(Cl-),c(OH-)=c(H+)
C.c(Cl-)>c(NH4+),c(OH-)>c(H+)
D.c(Cl-)>c(NH4+),c(H+)>c(OH-)
参考答案:C
本题解析:
本题难度:一般
2、选择题 下列说法正确的是
[? ]
A.酸、碱、盐都是电解质
B.电解质都是易溶于水的物质
C.氧化物都是电解质
D.氢化物都不是电解质
参考答案:A
本题解析:
本题难度:简单
3、选择题 常温下,下列有关电解质溶液的叙述正确的是
A.等浓度等体积的强酸与强碱溶液混合后,溶液的pH=7
B.将10?mL?pH=a的盐酸与100?mL?pH=b的Ba(OH)2溶液混合后恰好中和,则a+b=13
C.pH=10的Ba(OH)2溶液和pH=13的NaOH溶液等体积混合后溶液的pH=10.7(已知lg?2=0.3)
D.pH=2的盐酸与pH=12的氨水等体积混合后所得溶液显中性
参考答案:B
本题解析:分析:A.强酸强碱混合溶液的酸碱性不仅取决于酸碱的物质的量还取决于酸和碱的元数;
B.酸碱恰好中和,则盐酸中n(H+)等于氢氧化钡中n(OH-);
C.根据混合溶液中氢氧根离子浓度计算溶液的PH;
D.根据溶液中溶质判断溶液酸碱性.
解答:A.强酸强碱混合溶液的酸碱性不仅取决于酸碱的物质的量还取决于酸和碱的元数,如果n(H+)>n(OH-),溶液呈酸性,如果n(H+)>n(OH-),溶液呈中性,如果n(H+)<n(OH-),溶液呈碱性,故A错误;
B.氯化氢和氢氧化钡都是强电解质,酸碱恰好中和,则盐酸中n(H+)等于氢氧化钡中n(OH-),所以10-a mol/L×0.01L=1014-b mol/L×0.1L,则a+b=13,故B正确;
C.混合溶液中c(OH-)=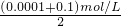 ,c(H+)=
,c(H+)=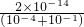 mol/L=2×10-13mol/L,pH=12.7,故C错误;
mol/L=2×10-13mol/L,pH=12.7,故C错误;
D.pH=2的盐酸与pH=12的氨水,氨水的物质的量浓度大于盐酸,所以两种溶液等体积混合后所得溶液显碱性,故D错误;
故选B.
点评:本题考查混合溶液酸碱性的判断及pH的有关计算,根据pH的计算公式及弱电解质电离特点来分析解答,难度中等.
本题难度:一般
4、选择题 已知在25℃条件下向10. 00 mL 0.1 mol/L HCOOH溶液中逐滴加入0.1 mol/LNaOH溶液,其pH 变化曲线如图所示(忽略温度变化)。下列说法中不正确的是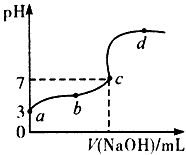
[? ]
A.a点表示的溶液中c(HCOO-)约为10-3 mol/L
B.用25 mL的酸式滴定管量取HCOOH溶液
C.c点NaOH溶液的体积小于10 mL
D.在a、c间任一点,溶液中一定都有c(Na+)>c(HCOO-)> c(H+)>c(OH-)
参考答案:D
本题解析:
本题难度:一般
5、选择题 下列物质中不属于电解质的是
A.固体氯化钾
B.液态氯化氢
C.气态硝酸
D.作电极的碳棒
参考答案:D
本题解析:试题分析:电解质是在水溶液中或熔融状态下能导电的化合物。A、固体氯化钾是在水溶液中和熔融状态下均能导电的化合物,属于电解质,故A不能选;液态氯化氢是在水溶液中能导电的化合物,属于电解质,故B不能选;气态硝酸是在水溶液中能导电的化合物,属于电解质,故C不能选;作电极的碳棒不是化合物,故不属于电解质。
考点:电解质
点评:本题考查电解质,属于对基础化学概念的考查,本题要理解好电解质的概念,本题比较容易。
本题难度:简单