时间:2017-11-11 02:05:36
1、选择题 如图所示,下列有关叙述正确的是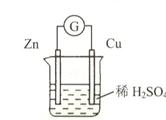
A.铜是负极,铜片上有气泡产生
B.铜片质量逐渐减少
C.锌是正极
D.氢离子被还原
参考答案:D
本题解析:该装置为铜锌原电池,铜为该电池的正极,锌片溶解,为电池的负极,A错误,铜是正极,铜片上有气泡产生;铜片质量并不发生变化,故B错误;锌是负极,故C错误,氢离子在铜极得到电子被还原,故D正确。
点评:本题考查了原电池的工作原理,该考点是高考考查的重点和难点,本题有利于考查学生对基础知识的掌握,该题难度不大。
本题难度:一般
2、选择题 某化学兴趣小组设计如图原电池:其中a、b分别为Cu和Ag,甲和乙分别是氨水和硝酸银溶液,盐桥的琼脂中吸附有KCl溶液,反应一段时间后,下列说法正确的是? ?
?
A.b为负极,电极方程式为:Ag + + e- =" Ag"
B.甲中出现大量蓝色沉淀
C.总反应为:Cu + 2 Ag + = Cu2+ + Ag
D.反应时,盐桥中的K+向乙方向移动
参考答案:D
本题解析:略
本题难度:一般
3、选择题 最近,科学家研制出一种纸质电池,这种“软电池”采用薄层纸片作为载体和传导体,在一边附着锌,在另一边附着二氧化锰.电池总反应为:Zn+2MnO2+H2O=ZnO+2MnO(OH)?关于此电池,下列说法正确的是( )
A.该电池Zn为负极,ZnO为正极,MnO2催化剂
B.该电池的正极反应为:MnO2+e-+H2O=MnO(OH)+OH-
C.放电时外电路电子由Zn流向MnO2,内电路电子由MnO2流向Zn
D.电池工作时OH-能通过薄层纸片向附着二氧化锰的电极移动
参考答案:A.反应中Zn被氧化,应为原电池的负极,MnO2被还原,应为原电池的正极,故A错误;
B.MnO2被还原,应为原电池的正极,电极反应式为MnO2+e-+H2O=MnO(OH)+OH-,故B正确;
C.放电时外电路电子由Zn流向MnO2,内电路由离子的定向移动形成闭合电路,故C错误;
D.电池工作时OH-向负极移动,故D错误.
故选B.
本题解析:
本题难度:一般
4、选择题 某MCFC型燃料电池可同时供应电和水蒸汽,其工作温度为600℃~700℃,所用燃料为氢气,电解质为熔融的K2CO3。该电池的总反应为:2H2+O2=2H2O,负极电极反应式为: H2+CO32——2e— H2O+CO2。则下列判断中正确的是 (? )?
H2O+CO2。则下列判断中正确的是 (? )?
A.放电时CO32—向负极移动
B.放电时CO32—向正极移动
C.正极反应: 4OH——4e—=2H2O+O2↑
D.当电池中生成1 mol水时,转移4 mol电子
参考答案:A
本题解析:根据题意知,该燃料电池燃料为氢气,电解质为熔融的K2CO3,总反应为2H2+O2=2H2O,负极反应为H2+CO32——2e— H2O+CO2,正极反应式:O2+2CO2+4e-
H2O+CO2,正极反应式:O2+2CO2+4e- 2CO32-。A、放电时CO32—向负极移动,正确;B、放电时CO32—应向负极移动,错误;C、正极反应式为:O2+2CO2+4e-
2CO32-。A、放电时CO32—向负极移动,正确;B、放电时CO32—应向负极移动,错误;C、正极反应式为:O2+2CO2+4e- 2CO32-,错误;D、当电池中生成1 mol水时,转移2 mol电子,错误。
2CO32-,错误;D、当电池中生成1 mol水时,转移2 mol电子,错误。
本题难度:一般
5、填空题 (16分)工业合成氨与制备硝酸一般可连续生产,流程如下: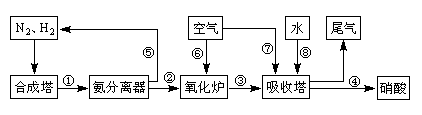
(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g) CO2(g)+H2(g)。t℃时,往10L密闭容器中充入2mol CO和3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。则该温度下此反应的平衡常数K= (填计算结果)。
CO2(g)+H2(g)。t℃时,往10L密闭容器中充入2mol CO和3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。则该温度下此反应的平衡常数K= (填计算结果)。
(2)合成塔中发生反应N2(g)+3H2(g) 2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1 300℃(填“>”、“<”或“=”)。
2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1 300℃(填“>”、“<”或“=”)。
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
参考答案:(1)(2分)1 (2)(2分)<
(3)(4分)负极 (2分) 2NH3 — 6e- + 6OH- =N2 +6H2O (2分。化学式1分、配平1分)
(4)(3分)CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g) △H=-867kJ/mol (方程式2分,
△H数值1分)
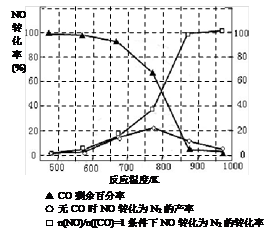
(5)(5分)该反应是放热反应(1分),当在775K反应达到平衡后继续升高温度(1分),平衡向逆(左)方向移动,NO转化率降低(1分) 870K(2分。写860-875K之间任意数值均给分)
本题解析:(1)根据“三段式”进行计算:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
初始浓度(mol?L?1) 0.2 0.3 0 0
转化浓度(mol?L?1) 0.12 0.12 0.12 0.12
平衡浓度(mol?L?1) 0.08 0.18 0.12 0.12
平衡常数K=0.12×0.12÷(0.08×0.18)=1。
(2)因为该反应△H<0,为放热反应,所以温度升高,平衡向逆反应方向移动,平衡常数减小,T1的平衡常数大于300℃时平衡常数,所以T1 < 300℃。
(3)燃料电池中,O2为正极,燃料为负极,所以通入氨气的电极是负极;NH3失去电子生成的单质为N2,所以电极方程式为:2NH3 — 6e- + 6OH- =N2 +6H2O
(4)NO2被还原为N2,则CH4被氧化为CO2,写出化学方程式并配平,CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g),根据盖斯定律求出焓变,△H=1/2△H1+1/2△H2=-867kJ?mol?1,可得热化学方程式。
(5)0~775K,为反应建立化学平衡的过程,775K时达到平衡,温度继续升高,NO的转化率减小,说明正反应为放热反应,温度升高,平衡向逆反应方向移动。
考点:本题考查平衡常数的判断及计算、燃料电池原理、热化学方程式的书写、化学平衡移动。
本题难度:困难