时间:2017-11-11 02:05:36
1、填空题 (本小题14分)氮气是制备含氮化合物的一种重要物质,而含氮化合物的用途广泛。
(1)图中表示两个常见的固氮反应: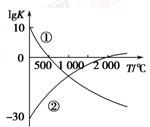
①N2+3H2 2NH3
2NH3
②N2+O2 2NO的平衡常数(lg K)与温度的关系,
2NO的平衡常数(lg K)与温度的关系,
根据图中的数据判断下列说法正确的是________(填序号)。
A.反应②为放热反应
B.常温下,反应①的反应速率很大,而反应②的反应速率很小
C.升高温度,反应①的反应速率增大,反应②的反应速率减小
D.在常温下,利用反应①固氮和利用反应②固氮反应程度相差很大
(2)工业上也可在碱性溶液中通过电解的方法实现由N2制取NH3:2N2+6H2O 4NH3+3O2,通入N2的一极是________(填“阴极”或“阳极”),阳极的电极反应式是____ ____。
4NH3+3O2,通入N2的一极是________(填“阴极”或“阳极”),阳极的电极反应式是____ ____。
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应:
①N2(g)+3H2O(l) 2NH3(g)+
2NH3(g)+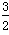 O2(g) ΔH=a kJ/mol。
O2(g) ΔH=a kJ/mol。
已知:②N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ/mol,
2NH3(g) ΔH=-92.4 kJ/mol,
2H2(g)+O2(g) 2H2O(l) ΔH=-571.6 kJ/mol,则a=__________。
2H2O(l) ΔH=-571.6 kJ/mol,则a=__________。
(4)已知:4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ΔH=-1316 kJ·mol-1,氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。
2N2(g)+6H2O(g) ΔH=-1316 kJ·mol-1,氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。
①当温度不同(T2>T1)、其他条件相同时,下列图像正确的是________(填代号)。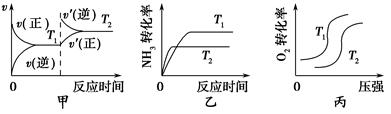
②该燃料电池的负极反应式是____________________________________。
(5)工业上合成氨时,温度过高,氨气的产率降低,试从化学平衡移动原理的角度加以解释:__________________________________________________________________。
参考答案:(本小题14分,每空2分)(1) d;(2)阴极;4OH--4e-=2H2O+O2↑ 或2H2O-4e-=O2↑+4H+
(3)+765.0 (4) ①乙 ② 2NH3-6e-+6OH-="==" N2↑+6H2O
(5)由工业合成氨反应N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ/mol可知该反应的正反应为放热反应,温度过高时,导致平衡逆向移动,因而氨气的产率降低。
2NH3(g) ΔH=-92.4 kJ/mol可知该反应的正反应为放热反应,温度过高时,导致平衡逆向移动,因而氨气的产率降低。
本题解析:根据图像①可知温度越高,平衡常数越小,说明升高温度,平衡逆向移动,逆反应方向是吸热反应,则该反应的正反应是放热反应;②温度越高,平衡常数越大,说明升高温度,平衡正向移动,正反应方向是吸热反应;所以选项A错误;B.常温下,由于N≡N的键能和H—H、O=O的键能都很大,所以反应①②的反应速率不大,错误;C.升高温度,无论是放热反应还是吸热反应,反应速率都增大,错误;D.在常温下,根据平衡常数可知:利用反应①固氮和利用反应②固氮反应程度相差很大,正确。(2)根据反应方程式可知:在反应中N2得到电子,作氧化剂,因此应该作阴极,在阳极则是OH-失去电子被氧化,电极反应式是4OH--4e-=2H2O+O2↑ 或2H2O-4e-=O2↑+4H+;(3)(②—①)×2÷3,整理可得,2H2(g)+O2(g) 2H2O(l) ΔH=-(92.4+a)×2÷3=—571.6 kJ/mol,则a=+765.0KJ/mol;(4) ①升高温度,正反应、逆反应的化学反应速率都加快,达到平衡所需要的时间缩短。所以甲错误;由于该反应的正反应是放热反应。根据平衡移动原理可知:升高温度,平衡逆向移动,达到平衡时NH3的转化率降低,乙错误;该反应的正反应是气体体积增大的反应,在其它条件不变时,增大压强,平衡向气体体积减小的逆反应方向移动,所以O2的转化率降低,错误。②该燃料电池的负极发生氧化反应,根据方程式可知NH3在反应中元素的化合价升高,失去电子,被氧化,因此在负极的电极反应式是2NH3-6e-+6OH-="==" N2↑+6H2O;(5)工业上合成氨时,温度过高,氨气的产率降低,这是由于合成氨的正反应是放热反应,升高温度,平衡向吸热反应方向移动,对该反应来说,平衡逆向移动,所以合成氨时,温度过高,氨气的产率降低。
2H2O(l) ΔH=-(92.4+a)×2÷3=—571.6 kJ/mol,则a=+765.0KJ/mol;(4) ①升高温度,正反应、逆反应的化学反应速率都加快,达到平衡所需要的时间缩短。所以甲错误;由于该反应的正反应是放热反应。根据平衡移动原理可知:升高温度,平衡逆向移动,达到平衡时NH3的转化率降低,乙错误;该反应的正反应是气体体积增大的反应,在其它条件不变时,增大压强,平衡向气体体积减小的逆反应方向移动,所以O2的转化率降低,错误。②该燃料电池的负极发生氧化反应,根据方程式可知NH3在反应中元素的化合价升高,失去电子,被氧化,因此在负极的电极反应式是2NH3-6e-+6OH-="==" N2↑+6H2O;(5)工业上合成氨时,温度过高,氨气的产率降低,这是由于合成氨的正反应是放热反应,升高温度,平衡向吸热反应方向移动,对该反应来说,平衡逆向移动,所以合成氨时,温度过高,氨气的产率降低。
考点:考查热化学方程式的书写、温度对平衡的影响、原电池 原理的应用、反应条件的选择与物质产率的关系的知识。
本题难度:困难
2、选择题 有关右图装置中的叙述正确的是 
A.这是电解NaOH溶液的装置
B.这是一个原电池装置
C.Pt为负极,其电极反应为:O2+2H2O+4e-= 4OH-
D.Fe为阳极,其电极反应为:Fe-2e-+2OH- = 2Fe(OH)2
参考答案:B
本题解析:A、由题给装置图知,该装置无外加直流电源,不是电解NaOH溶液的装置,错误;B、这是一个原电池装置,正确;C、原电池中较活泼的金属作负极,故Pt为正极,其电极反应为:
O2+2H2O+4e-= 4OH-,错误;D、原电池中较活泼的金属作负极,Fe为负极,其电极反应为:
Fe-2e-+2OH- = 2Fe(OH)2,错误。
本题难度:一般
3、选择题 X、Y、Z三种金属,X、Y组成原电池时,X是负极;把Y放在Z的硝酸盐溶液中,Y表面有Z析出。X、Y、Z的活泼性顺序是
[? ]
A.X>Z>Y?
B.Z>Y>X?
C.X>Y>Z?
D.Y>X>Z
参考答案:C
本题解析:
本题难度:简单
4、选择题 铜锌原电池(如图)工作时,下列叙述不正确的是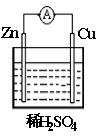
A.锌电极上的反应是:Zn-2e- Zn2+
Zn2+
B.铜电极上得到电子,发生还原反应[
C.在外电路中,电子从负极流向正极
D.电池总反应为:Zn+Cu2+ Zn2+ +Cu
Zn2+ +Cu
参考答案:D
本题解析:略
本题难度:简单
5、选择题 关于锌、铜和稀硫酸构成的原电池,下列说法中正确的是
[? ]
A.锌是正极、铜是负极
B.电子从铜片经导线流向锌片
C.负极的反应式为2H++2e- = H2↑
D.反应一段时间后,溶液的pH升高
参考答案:D
本题解析:
本题难度:一般