时间:2017-11-11 01:58:27
1、选择题 某小组为了研究电化学原理设计了如图所示的装置,下列说法中错误的是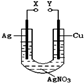
A.X和Y不连接时,铜棒上会有金属银析出
B.X和Y用导线连接时,银棒是正极,发生氧化反应
C.若X接直流电源的正极,Y接负极,Ag+向铜电极移动
D.无论X和Y是否用导线连接,铜棒均会溶解,溶液都从无色逐渐变成蓝色
参考答案:B
本题解析:A.X和Y不连接时,铜可以置换出银单质,正确;B.X和Y用导线连接时,构成原电池,Ag做正极,发生还原反应,Cu作负极,发生氧化反应,错误;C.若X接直流电源的正极,Y接负极,构成电解池,Ag做阳极,Cu作阴极,Ag+向铜电极移动,正确;D.无论X和Y是否连接,铜都会失去电子变成铜离子,正确。
考点:考查电化学原理。
本题难度:一般
2、选择题 用选项中的电极、溶液和如图所示装置可组成原电池。下列现象或结论叙述正确的是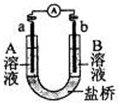
| 选项 | 电极a | 电极b | A溶液 | B溶液 | 现象或结论 |
| A | Cu | Zn | CuSO4 | ZnSO4 | 一段时间后,a增加的质量与b减少的质量相等 |
| B | Cu | Zn | 稀H2SO4 | ZnSO4 | 盐桥中阳离子向b极移动 |
| C | C | C | FeCl3 | KI、淀粉混 合液 | b极附近溶液变蓝 |
| D | Fe | C | NaCl | FeCl3 | 外电路电子转移方向:b→a |
参考答案:C
本题解析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。据此可知:A、该原电池中,负极上的电极反应式为:Zn-2e-=Zn2+,正极上的电极反应式为:Cu2++2e-=Cu,当转移电子数相等时,参加反应的两种金属的物质的量相等,根据m=nM知,由于M不同,所以参加反应的金属的质量不同,故A错误;B、锌比铜活泼,所以该原电池中,电极b作负极,电极a作正极,原电池放电时,盐桥中的阳离子向a极移动,故B错误; C、铁离子具有氧化性,能氧化碘离子,所以该原电池中,电极b作负极,电极a作正极,负极上碘离子失电子生成碘单质,淀粉溶液遇碘变蓝色,所以b极附近溶液变蓝,故C正确;D、铁是活泼的金属,所以该原电池中,电极a作负极,电极b作正极,原电池放电时,外电路上电子从电极a沿导线流向电极b,故D错误,答案选C。
本题难度:一般
3、选择题 一种新型燃料电池,以多孔镍板为电极,以KOH溶液为电解液。分别向两极通入乙烷和氧气,其电极反应式为: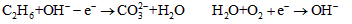 (均未配平)有关对此电池的推断正确的是?
(均未配平)有关对此电池的推断正确的是?
[? ]
A.电解质溶液中,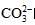 向正极移动
向正极移动
B.放电一段时间后,KOH的浓度不变
C.参加反应的O2与C2H6的物质的量之比为7:2
D.通乙烷的电极为正极
参考答案:C
本题解析:
本题难度:一般
4、选择题 在理论上不能用于设计原电池的化学反应是?
A.NaCl(aq)+ AgNO3(aq)= AgCl(s)+ NaNO3(aq )△H<0
B.2CH3OH (l) +3O2(g) = 2CO2(g) + 4H2O (l)△H<0
C.2FeCl3(aq)+Fe(s) = 3FeCl3(aq)△H < 0
D.2H2 (g) + O2 (g) = 2H2O (l)△H < 0
参考答案:A
本题解析:只有在氧化还原反应中才有电子的得失,因此只有氧化还原反应才能设计成原电池,据此可知选项BCD都是可以设计成原电池的。选项A中反应是复分解反应,不是氧化还原反应,不能设计成原电池,答案选A。
点评:该题是基础性试题的考查,主要是考查学生对原电池原理的熟悉了解程度,意在培养学生的逻辑推理能力。该题的关键是明确原电池的工作原理,然后结合具体的化学方程式灵活运用即可。
本题难度:一般
5、选择题 下列说法正确的是( )
A.钢铁发生电化学腐蚀的正极反应式:Fe═Fe2++2e-
B.氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH-
C.粗铜精炼时,与电源正极相连的是纯铜
D.在铁上镀铜时,可用CuSO4溶液作为电解液
参考答案:A.钢铁的电化学腐蚀中,负极上电极反应式为:Fe-2e-═Fe2+,故A错误;
B.氢氧燃料电池中,正极反应式:O2+2H2O+4e-═4OH-,故B错误;
C.粗铜精炼时,与电源正极相连的是粗铜,故C错误;
D、在铁上镀铜时,电解质溶液必须含有铜元素,所以可用CuSO4溶液作为电解液,故D正确.
故选D.
本题解析:
本题难度:一般