时间:2017-11-11 01:33:20
1、选择题 根据金属活动性顺序表,Cu不能发生:Cu+2H2O=Cu(OH)2+H2↑的反应.但选择恰当电极材料和电解液进行电解,这个反应就能变为现实.下列四组电极和电解液中,能实现该反应最为恰当的是
| | 阳极 | 阴极 | 电解液 |
| A. | 石墨棒 | 石墨棒 | CuSO4溶液 |
| B. | Cu | 石墨棒 | Na2SO4溶液 |
| C. | Cu | Fe | H2SO4溶液 |
| D. | Cu | Pt | H2O |
2、填空题 某兴趣小组利用如图所示装置进行实验。
(1)断开K2、闭合K1,U形管内除电极上有气泡外,还可观察到的现象是 ;阳极电极反应式为 。当电路中转移0.001mol电子时,右侧注射器最多可以收集到气体 mL(折算为标准状况)。
(2)断开K2、闭合K1一段时间,待注射器中充有一定量的气体后,断开K1、闭合K2,此时装置内化学能转化为电能。实现能量转化的化学方程式为 ;
(3)假设实验装置不漏气,当(2)中注射器内气体全部参加反应后,U形管内的溶液理论上 (填“能”或“不能”)恢复原样。
3、选择题 用石墨作电极,电解1mol/L下列物质的溶液,溶液的pH值保持不变的是( )
A.HCl
B.NaOH
C.K2SO4
D.NaCl
4、填空题 光伏组件采用高效率单晶硅或多晶硅光伏电池、高透光率钢化玻璃、抗腐蚀铝合多边框等材料,使用先进的真空层压工艺及脉冲焊接工艺制造。
(1)钢化玻璃的成分为____________(写化学式)。
(2)光伏电池的能量转换形式正确的是__________(填字母代号)。
a.化学能转换为电能
b.光能转换为化学能再转换为电能
c.光能转换为热能再转换为电能
d.光能转换为电能
(3)下图是太阳能电池板经太阳光照射前后内部电子的变化情况,图乙中灯泡变亮,其中___(填写“N” 或“P”)是正极。 
(4)下图是一个太阳能路灯,图中的④是蓄电池。镍氢电池就是这样一种与太阳能电池配套使用的蓄电 池,白天用于充电,夜间供电。这种蓄电池容量大,充电放电循环寿命也较长。该蓄电池的总反应为:
Ni(OH)2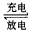 NiOOH+1/2H2↑。
NiOOH+1/2H2↑。 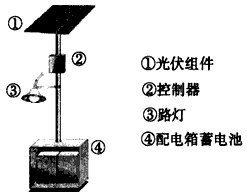
镍氢电池的电解液采用30%的KOH溶液,白天充电反应时的阳极反应式为_______________,夜间放电时,负极附近溶液的pH______(填“增大”、“减小”或“不变”)。
5、选择题 下列叙述中不正确的是
[? ]
A.电解池的阳极上发生氧化反应,阴极上发生还原反应
B.原电池的正极上发生氧化反应,负极上发生还原反应
C.电镀时,电镀池里的阳极材料发生氧化反应
D.用原电池做电源进行电解时,电子从原电池负极流向电解池阴极