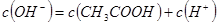1、选择题 室温时,将浓度和体积分别为c1、V1的NaOH溶液和c2、V2的
CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是(?)
A.若pH>7,则一定是c1V1=c2V2
B.在任何情况下都是c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.当pH=7时,若V1=V2,则一定是c2>c1
D.若V1=V2,c1=c2,则c(CH3COO-)+c(CH3COOH)=c(Na+)
参考答案:A
本题解析:本题考查电解质溶液的相关知识,意在考查考生对电解质溶液中离子浓度之间的关系、盐类的水解等知识的掌握情况。氢氧化钠为强碱,醋酸为弱酸,两溶液混合时,若恰好完全反应,则得到醋酸钠溶液,溶液显碱性,pH>7,若醋酸溶液稍过量,pH也可能大于7,而碱过量时溶液一定显碱性,pH>7,因此A选项错误;由电荷守恒知B选项正确;溶液pH=7时酸过量,C选项正确;由物料守恒知D选项正确。
本题难度:一般
2、选择题 常温时,将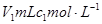 的醋酸滴加到
的醋酸滴加到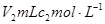 的烧碱溶液中,下列结论正确的是
的烧碱溶液中,下列结论正确的是
A.若混合溶液的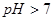 ,则混合溶液中
,则混合溶液中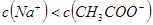
B.若混合溶液的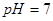 ,则混合溶液中
,则混合溶液中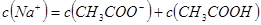
C.若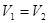 ,且混合溶液
,且混合溶液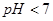 ,则必有
,则必有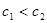
D.若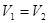 ,
,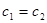 ,则混合溶液中
,则混合溶液中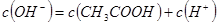
参考答案:D
本题解析:根据电荷守恒c(H+)+c(Na+)=c(CH3COO-)+c(OH-)可知,如果pH大于7,则c(Na+)大于c(CH3COO-),A不正确。如果pH=7,则c(Na+)=c(CH3COO-),B不正确。PH小于7,说明溶液显酸性,此时醋酸一定是过量的,所以c1大于c2,C不正确。选项D中二者恰好反应,生成的醋酸钠水解显碱性,根据质子守恒可知,D正确,答案选D。
本题难度:一般
3、选择题 用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是(? )
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
参考答案:A、D
本题解析:试题分析:
本题难度:一般
4、填空题 (9分)(1)Na2CO3的水溶液呈??(填“酸”、“中”、“碱”)性,常温时的pH ?7(填“>”、“=”、“<”),原因是(用离子方程式表示):?;?(2)氯化铝水溶液呈?性,原因是(用离子方程式表示):_____________________ 。
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是??。
参考答案:(1)碱性;(1分)? > (1分); CO32-+H2O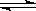 HCO3-+OH-(2分)
HCO3-+OH-(2分)
(2)酸性;(1分) Al3++3H2O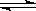 Al(OH) 3+3H+ (2分) ;Al2O3? (2分)
Al(OH) 3+3H+ (2分) ;Al2O3? (2分)
本题解析:(1)碳酸钠是强碱弱酸盐,水解显碱性,显÷常温下pH大于7,水解方程式为CO32-+H2O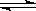 HCO3-+OH-。
HCO3-+OH-。
(2)氯化铝是强酸弱碱盐,水解显酸性,水解方程式为Al3++3H2O Al(OH) 3+3H+。由于水解是吸热的,而生成物氯化氢又易挥发,所以最终得到是氢氧化铝沉淀,灼烧得到氧化铝。
Al(OH) 3+3H+。由于水解是吸热的,而生成物氯化氢又易挥发,所以最终得到是氢氧化铝沉淀,灼烧得到氧化铝。
本题难度:简单
5、选择题 把1mL0.1mol/L的H2SO4溶液加入蒸馏水中,制成200ml溶液,稀释后的H2SO4中,由水自身电离产生的c(H+)最接近:
A.1×10-13mol/L
B.1×10-3mol/L
C.1×10-7mol/L
D.1×10-11mol/L
参考答案:D
本题解析:由C1V1=C2V2,得:C(稀释后H2SO4)= 5×10-4mol/L,即C酸(H+)= 1×10-3mol/L
(酸性溶液可忽略[H+]水)代入Kw=[H+][OH-],得:[OH-]=1×10-11mol/L=[OH-]水?
因为: H2O  ?H++OH-,所以:[H+]水==[OH-]水=1×10-11mol/L,故选D
?H++OH-,所以:[H+]水==[OH-]水=1×10-11mol/L,故选D
本题难度:一般
微信搜索关注"91考试网"公众号,领30元,获取公务员事业编教师考试资料40G
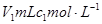 的醋酸滴加到
的醋酸滴加到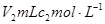 的烧碱溶液中,下列结论正确的是
的烧碱溶液中,下列结论正确的是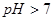 ,则混合溶液中
,则混合溶液中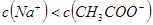
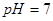 ,则混合溶液中
,则混合溶液中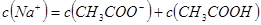
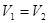 ,且混合溶液
,且混合溶液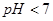 ,则必有
,则必有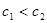
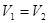 ,
,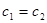 ,则混合溶液中
,则混合溶液中