时间:2017-11-11 01:27:25
1、填空题 海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/mg·L-1 | 9 360 | 83 | 200 | 1 100 | 16 000 | 1 200 | 118 |


参考答案:(1)①2H2O+2e-=H2↑+2OH-
②Ca2++OH-+HCO3-=CaCO3↓+H2O
③b
(2)正 FePO4+e-+Li+=LiFePO4
本题解析:(1)①电解海水,阴极是H+得电子,而不是活泼金属阳离子,2H2O+2e-=H2↑+2OH-。
②由于在阴极区H+不断放电,破坏水的电离平衡,c(OH-)增大,致使Ca2++OH-+HCO3-=CaCO3↓+H2O。
③因为在阴极区除去Ca2+、Mg2+,所以淡水应b口出。
(2)放电时的电极反应式分别为负极:Li-e-=Li+,
正极:FePO4+Li++e-=LiFePO4。
本题难度:一般
2、填空题 能源问题是当前人类社会面临的一项重大课题,H2、CO、CH3OH都是重要的能源物质,它们的燃烧热依次为285.8 kJ/mol、282.5 kJ/mol、726.7 kJ/mol。请回答:
(1)已知CO和H2在一定条件下可以合成甲醇:CO+2H2=CH3OH。则H2与CO反应生成CH3OH的热化学方程式为: 。
(2)如图为某种燃料电池的工作原理示意图,a、b均为惰性电极。
①使用时,空气从 口通入(填“A”或“B”);
②假设使用的“燃料”是甲醇,a极的电极反应式为: ________________
③假设使用的“燃料”是水煤气(成分为CO、H2)用这种电池电镀铜,待镀金属增重6.4 g,则至少消耗标准状况下水煤气的体积为 。
参考答案:(1)CO(g)+2H2(g)=CH3OH(l) ΔH="-127.4" kJ/mol
(2)①B
②CH3OH -6e-+8OH-=CO32-+6H2O
③2.24 L
本题解析:(1)根据所给信息可以写出H2、CO、CH3OH燃烧热的热化学方程式。
(2)①从图上可以看出,电子由a流向b,因而a为负极,b为正极,空气应该进入正极区。
②注意甲醇失去电子,生成的CO2要与OH-反应转化为CO32-。
③待镀金属增重6.4 g,即析出0.1 mol Cu,电子转移0.2 mol,则消耗水煤气0.1 mol,标准状况下体积为2.24 L
本题难度:一般
3、选择题 由铜、锌和稀硫酸组成的原电池中,下列各叙述正确的是( )
A.溶液中pH由大变小
B.溶液中的SO42-向原电池的正极移动
C.Zn为电池的负极,电极反应:Zn
参考答案:
本题解析:
本题难度:一般
4、选择题 锂~碘电池可用来为心脏起搏器提供能源,其电池反应可简化为:2Li + I2?= 2LiI。下列有关说法正确的是
A.I2发生氧化反应
B.碘电极为该电池的正极
C.正极反应为:Li –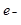 = Li+
= Li+
D.该电池放电时化学能转化为电能
参考答案:BD
本题解析:由总反应式可知,化合价升高的做负极,所以锂做负极。碘做正极。所以碘发生的是还原反应。原电池是将化学能转化为电能的装置,所以答案选BD
本题难度:一般
5、选择题 关于下列装置说法正确的是( )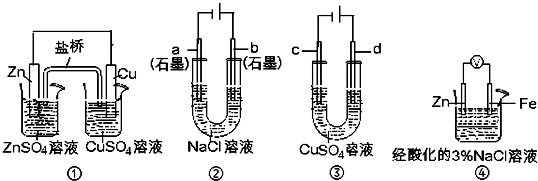
A.用装置③精炼铜时,c极为粗铜
B.装置①中,盐桥中的K+移向ZnSO4溶液
C.装置②工作一段时间后,a极附近溶液的pH增大
D.装置④中电子由Zn流向Fe,装置中有Fe2+生成
参考答案:A、装置③精炼铜时,阳极d极应该是粗铜,阴极c极是纯铜,故A错误;
B、装置①原电池中,Zn是负极,Cu是正极,电解质里的阳离子K+移向正极,即移向硫酸铜溶液,故B错误;
C、在装置②电解池中,阴极a极是氢离子发生得电子生成氢气的还原反应,该极附近碱性增强,所以a极附近溶液的pH增大,故C正确;
D、在该原电池中,电子从负极Zn即流向正极Fe极,在铁电极上氢离子得电子生成氢气,反应实质是金属锌和氢离子之间的反应,不会产生亚铁离子,故D错误.
故选C.
本题解析:
本题难度:一般