时间:2017-11-11 01:21:11
1、选择题 下列分子的比例模型中,中心原子上存在孤对电子的是
A.
B.
C.
D.
2、选择题 下列物质中既有离子键又有共价键的是( )
A.CaCl2
B.H2O
C.K2O
D.NaOH
3、选择题 A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物显碱性,且碱性B>A;C、D两种元素对应气态氢化物的稳定性C>D;E是这五种元素中形成简单离子半径最小的元素.则它们的原子序数由小到大的顺序为( )
A.D<C<E<A<B
B.A<B<C<D<E
C.E<B<A<C<D
D.B<A<E<D<C
4、选择题 下列表达方式错误的是
[? ]
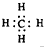
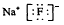
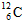
5、填空题 (21分)Ⅰ、氯化铬酰(CrO2Cl2)在有机合成中可作 氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
⑴写出铬原子的基态电子排布式_____________________,与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有_____(填元素符号),其中一种金属的晶胞结构如图所示,该晶胞中含有金属原子的数目为??。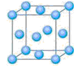
⑵CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断?
CrO2Cl2是_______(填“极性”或“非极性”)分子。
⑶在①苯?②CH3OH?③HCHO?④CS2?⑤CCl4?⑥CH3Cl?⑦HCOOH七种有机物质中,碳原子采取sp2杂化的分子有________(填序号),CS2 分子的空间构型是_______。
分子的空间构型是_______。
Ⅱ、不锈钢是由铁、铬、镍、碳及众多不同元素所组 成的合金。
成的合金。
(1)基 态碳(C)原子的价电子排布式为 。
态碳(C)原子的价电子排布式为 。
(2)[Cr(H2O)4Cl2]Cl·2H2O中Cr3+的配位数为? ;[Cr(H2O)4Cl2]Cl中含有的化学键为?。
(3)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。423K时,Ni(CO )4分解为Ni和CO,从而制得高纯度的Ni粉。试推测:四羰基镍的晶体类型是? ?, Ni(CO)4易溶于??(填序号)。
)4分解为Ni和CO,从而制得高纯度的Ni粉。试推测:四羰基镍的晶体类型是? ?, Ni(CO)4易溶于??(填序号)。
A.水? B.四氯化碳? ? C.苯? ? D.硫酸镍溶液
(4)据报道,只含镁、镍和碳三 种元素的晶体竟然具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该晶体的结构可看作由镁原子和镍原子在一起进行面心立方密堆积,试写出该晶体的化学式?。晶体中
种元素的晶体竟然具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该晶体的结构可看作由镁原子和镍原子在一起进行面心立方密堆积,试写出该晶体的化学式?。晶体中 每个镁原子周围距离最近的镍原子有?个。
每个镁原子周围距离最近的镍原子有?个。