时间:2017-11-11 01:20:49
1、选择题 下列物质中,具有非极性键的离子化合物是
A.H2O2
B.MgF2
C.NH4Cl
D.Na2O2
参考答案:D
本题解析:
本题难度:困难
2、选择题 根据下表中所列键能数据,判断下列分子中,最不稳定的分子是?
A.HCl
B.HBr
C.H2
D.Br2
参考答案:D
本题解析:对于分子晶体,共价键的键能越大,分子是越稳定的,根据表中的键能可以判断单质溴是最不稳定的。答案是D。
本题难度:困难
3、选择题 NA为阿伏加德罗常数的值,下列说法正确的是
A.2.3g金属钠变成钠离子时失去的电子数目为0.1NA
B.在常温常压下,11.2L氧气含有的电子数为8NA
C.标准状况下,22.4L单质溴含有的原子数为2NA
D.惰性电极电解饱和食盐水若产生2g H2,则生成的氯气为2mol
参考答案:A
本题解析:分析:A、依据n=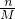 计算物质的量,结合钠原子最外层一个电子计算;
计算物质的量,结合钠原子最外层一个电子计算;
B、依据气体摩尔体积的条件应用是标准状况下的气体分析判断;
C、标准状况溴单质不是气体;
D、电解饱和食盐水生成氢气和氯气物质的量相同;
解答:A、2.3g金属钠物质的量为0.1mol,变成钠离子时失去的电子数目为0.1NA,故A正确;
B、不在标准状况下,11.2L氧气不是0.5mol,故B错误;
C、标准状况溴单质不是气体,22.4L单质溴不是1mol,故C错误;
D、惰性电极电解饱和食盐水,2NaCl+2H2O 2NaOH+H2↑+Cl2↑,若产生2g H2物质的量为1mol,则生成的氯气为1mol,故D错误;
2NaOH+H2↑+Cl2↑,若产生2g H2物质的量为1mol,则生成的氯气为1mol,故D错误;
故选A.
点评:本题考查了阿伏伽德罗常的应用.主要是质量换算物质的量计算微粒数,气体摩尔体积的条件应用,电解原理的计算题目难度中等.
本题难度:困难
4、选择题 在相同条件下,将相同物质的量的Na、Mg、Al分别加入盛有同浓度、同体积稀盐酸的甲、乙、丙三个烧杯中充分反应,生成气体的体积关系不可能是
A.甲(Na)>乙(Mg)>丙(?Al)
B.甲(Na)>乙(Mg)=丙(?Al)
C.甲(Na)<乙(Mg)<丙(?Al)
D.甲(Na)=乙(?Mg)=丙(Al)
参考答案:A
本题解析:分析:分情况讨论:
①酸不足量,且三种金属与酸反应后都过量时;
②三种金属都不足量、酸过量时;
③酸不足量且钠与酸恰好完全反应时;
然后依据发生的化学反应来分析.
解答:三种金属与酸反应的方程式分别为:
2Na+2HCl=2NaCl+H2↑、Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,
A、镁、铝只和酸反应,钠和酸、水都反应,无论酸过量还是金属过量,都不会出现甲(Na)>乙(Mg)>丙(Al),故A错误;
B、酸不足量,且三种金属与酸反应后都过量时,镁、铝只和酸反应,所以乙、丙两支试管得到的氢气全部来自于酸,所以产生的氢气体积相同;钠不仅和酸反应还和水反应,所以甲试管的氢气来自于为水和酸,导致甲试管得到的氢气体积大于乙、丙两支试管得到的氢气,故B正确;
C、三种金属不足量、酸过量时,以金属为标准进行金属,根据方程式知,生成的氢气最多的为铝,其次为镁,最少的为钠,故C正确;
D、酸不足量且钠与酸恰好完全反应时,生成的氢气全部来自于酸,因为酸的量相同,所以生成的氢气相同,故D正确;
故选A.
点评:本题考查了有关方程式的计算及过量问题,难度不大,注意钠不仅和酸反应还和水反应,这是解题的易错点.
本题难度:简单
5、选择题 镁、铝、铁三种金属粉末混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量氢氧化钠溶液,再过滤,滤液中存在的离子有
A.Mg2+
B.AlO
C.Al3+
D.Fe2+
参考答案:B
本题解析:分析:镁、铝、铁三种金属粉末混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量氢氧化钠溶液,发生的离子反应有:Mg+2H+=H2↑+Mg2+、2Al+6H+=3H2↑+2Al3+、Fe+2H+=Fe2++H2↑、H++OH-=H2O、Mg2++2OH-=Mg(OH)2↓、Fe2++2OH-=Fe(OH)2↓、Al3++4OH-=AlO2-+2H2O,根据溶液中的溶质确定存在的离子.
解答:镁、铝、铁三种金属粉末混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量氢氧化钠溶液,发生的离子反应有:Mg+2H+=H2↑+Mg2+、2Al+6H+=3H2↑+2Al3+、Fe+2H+=Fe2++H2↑、H++OH-=H2O、Mg2++2OH-=Mg(OH)2↓、Fe2++2OH-=Fe(OH)2↓、Al3++4OH-=AlO2-+2H2O,根据离子方程式知,镁、铁都生成沉淀,铝元素存在于AlO2-中,故选B.
点评:本题以元素的存在方式为载体考查了金属的性质,明确发生的离子反应是解本题关键,难度不大.
本题难度:困难