时间:2017-11-11 01:16:09
1、选择题 能把Na2SO4、NH4NO3、 KCl、(NH4)2SO4四瓶无色溶液加以区别的一种试剂是(必要时可以加热)(?)
KCl、(NH4)2SO4四瓶无色溶液加以区别的一种试剂是(必要时可以加热)(?)
A.BaCl2
B.NaOH
C.Ba(OH)2
D.AgNO3
参考答案:C
本题解析:略
本题难度:简单
2、填空题 (5分)在盛有AgNO3、HBr、Na2CO3、CaCl2、NaI五种无色溶液的试剂瓶上,分别贴有①~⑤的编号。将它们两两混合,产生的现象如下表所列:
| ? | ① | ② | ③ | ④ | ⑤ |
| ① | —— | ↑无色 | ↓白色 | ↓白色 | 无明显现象 |
| ② | ↑无色 | —— | 无明显现象 | ↓淡黄色 | 无明显现象 |
| ③ | ↓白色 | 无明显现象 | —— | ↓白色 | 无明显现象 |
| ④ | ↓白色 | ↓淡黄色 | ↓白色 | —— | ↓黄色 |
| ⑤ | 无明显现象 | 无明显现象 | 无明显现象 | ↓黄色 | —— |
| 结论 | ? | ? | ? | ? | ? |
参考答案:Na2CO3?HBr? CaCl2 ?AgNO3 ?NaI
本题解析:略
本题难度:简单
3、选择题 下列所采取的分离方法正确的是(?)
A.由于碘在酒精中的溶解度大,所以可用酒精将碘水中的碘萃取出来
B.水的沸点是100℃,酒精的沸点是78.5℃,所以可用直接加热蒸馏法使含水酒精变为无水酒精
C.可用冷却热的饱和氯化钾和氯化钠混合溶液的方法得到纯净的氯化钠晶体
D.由于胶体微粒的直径比离子大,所以碘化钾混入淀粉中可用渗析法分离
参考答案:D
本题解析:A 错误,酒精不能做萃取剂,因为酒精溶于水,不分层
B 错误,沸点相差不大,得不到无水酒精,应在水酒精中加氧化钙,在加热蒸馏变为无水酒精
C 错误,氯化钾和氯化钠的溶解度都随温度变化不大,得不到纯净的氯化钠晶体
D 正确
本题难度:一般
4、选择题 下列实验中,依据实验操作及现象,得出的结论正确的是(?)
| ? | 操 作 | 现 象 | 结 论 | ||||||||||||
| A | 测定等浓度的Na2CO3和Na2SO3 溶液的pH | 前者pH比后者的大 | 非金属性: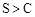 | ||||||||||||
| B | 无色溶液中滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有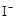 | ||||||||||||
| C | 向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 | 生成白色沉淀 | 溶液X中一定含有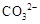 或 或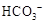 | ||||||||||||
| D | 向某无色溶液中滴加硝酸酸化的BaCl2溶液 | 产生白色沉淀 | 溶液中不一定含有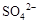 参考答案:BD 本题解析:比较S和C的非金属性,应该比较对应元素的最高价氧化物的水化物的盐溶液的PH,所以A错误;能使澄清石灰水变浑浊的气体有二氧化碳和二氧化硫,所以C项错误;BD正确,故选BD。 本题难度:一般 5、填空题 锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β?锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂。其中一种工艺流程如下:
请回答下列问题: (1)写出反应Ⅰ中有电子转移的化学方程式_________________________; (2)反应Ⅱ加入碳酸钙的作用是_______________; (3)有同学认为在反应Ⅲ中只需加入碳酸钠溶液也能达成该步骤的目的,请阐述你的观点和理由? ____________; (4)上述流程蒸发浓缩环节,若在实验室进行该操作,当蒸发浓缩至________出现时,就可停止该操作。 (5)Li与Mg、Be与Al、B与Si这三对元素在周期表中处于对角线位置,相应的两元素及其化合物的性质有许多相似之处。这种相似性称为对角线规则。步骤③中电解时,阳极产生的氯气中会混有少量氧气,原因是___________。 (6)请设计一种从水洗后的矿泥中分离出Al2O3的流程: (流程常用的表示方式为:  ) )参考答案: 本题解析: 本题难度:困难 |