时间:2017-11-11 01:07:17
1、选择题 能使0.1mol/LCH3COONa溶液的pH值增大的方法是
A.加水
B.加盐酸
C.加热
D.加氯化铵晶体
参考答案:C
本题解析:
CH3COONa溶液中CH3COO-可以发生水解反应:CH3COO-+H2O CH3COOH+OH-,
CH3COOH+OH-,
A.加水稀释,虽然促进了水解,但c(OH-)是减小的,故pH值减小,故A不合题意;
B.加盐酸,消耗OH-,虽然促进了水解,但c(OH-)是减小的,故pH值减小,故B不合题意;
C.解热促进水解平衡右移,使c(OH-)增大,故pH值增大,故C符合题意;
D.加氯化铵晶体,NH4+会与OH-结合,使c(OH-)减小,故pH值减小,故D不合题意。
考点:考查盐类的水解的影响因素
点评:本题考查了盐类的水解的影响因素,难度不大。解题时应从平衡移动的角度来分析盐类水解的影响因素对平衡的移动。
本题难度:一般
2、选择题 将0.4 mol/L的CH3COOK与0.2 mol/L的HCl等体积混合后,溶液中下列微粒的物质的量浓度关系正确的是
A.c(CH3COO-)=c(Cl-)>c(H+)>c(OH-)
B.c(CH3COO-)=c(Cl-)>c(H+)>c(CH3COOH)
C.c(K+)+c(H+)=c(CH3COO-)+c(Cl-)
D.c(K+)>c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
参考答案:D
本题解析:
本题难度:困难
3、选择题 0.1mol/L的K2S溶液中,有关粒子的浓度大小关系正确的是
A.c(K+)+c(H+)=c(S2—)+c(HS—)+c(OH—)
B.c(H+)= c(OH—)
C.c(K+)=c(S2—)+c(HS—)+c(H2S)
D.c(OH-)=c(H+)+c(HS—)+2c(H2S)
参考答案:D
本题解析:A、根据电荷守恒可知c(K+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),A不正确;B、强碱弱酸盐水解溶液应呈碱性c(H+)<c(OH—),B不正确;C、根据物料守恒可知c(K+)=2c(S2-)+2c(HS-)+2c(H2S),C不正确;
D、根据质子守恒可知c(OH-)=c(H+)+c(HS-)+2c(H2S),D正确。
考点:了解盐类水解的原理、盐溶液酸碱性、影响盐类水解程度的主要因素、盐类水解的应用。
点评:主要考查对盐类水解判断溶液酸碱性、电解质溶液中三“守恒”等考点的理解。电荷守恒式注意关注离子电荷数,物料守恒重点是弄清所考查原子的个数比,质子守恒应重点分析H+与失去H+所得到的离子的去向。
本题难度:一般
4、选择题 已知NaHSO3溶液显酸性,溶液中存在以下平衡:
HSO3
参考答案:
本题解析:
本题难度:困难
5、填空题 写出下列盐溶液的水解离子方程式:
(1)Fe(NO3)3 ;
(2)NaF ;
(3)K2CO3 ; ;
参考答案:(1)Fe3+ +3H2O 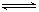 Fe(OH)3 + 3H +
Fe(OH)3 + 3H +
(2)F- +H2O 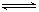 HF + OH-
HF + OH-
(3)CO32-+H2O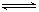 HCO3-+ OH- ;
HCO3-+ OH- ;
HCO3-+H2O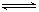 H2CO3+ OH-
H2CO3+ OH-
本题解析:(1)多元弱碱阳离子一步水解
(3)多元弱酸的酸根离子要分多步水解
本题难度:一般